导读:中国抗癌协会乳腺癌专业委员会 . 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31 (10): 954-1040.浸润性乳腺癌保乳治疗临床指南7.1 浸润性乳腺癌
中国抗癌协会乳腺癌专业委员会 . 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31 (10): 954-1040.
浸润性乳腺癌保乳治疗临床指南
7.1 浸润性乳腺癌保乳治疗的外科技术
7.1.1 开展保乳治疗的必要条件
⑴ 开展保乳治疗的医疗单位应该具备相关的技术和设备条件,以及外科、病理科、影像诊断科、放疗科和内科的密切合作(上述各科也可以分布在不同的医疗单位),并有健全的随访机制。
⑵ 患者在充分了解全乳腺切除治疗与保乳治疗的特点和区别之后,知晓保乳后可能的局部复发风险,具有明确的保乳意愿。
⑶ 患者客观上有条件接受保乳手术后的放疗及相关的影像学随访,如乳腺X线、B超或MRI检查等(必须充分考虑患者的经济条件、居住地的就医条件及全身健康状况等)。
7.1.2 保乳治疗的适应证
主要针对具有保乳意愿且无保乳禁忌证的患者。
7.1.2.1 临床Ⅰ、Ⅱ期的早期乳腺癌
肿瘤大小属于T1和T2分期,且乳房有适当体积,肿瘤与乳房体积比例适当,术后能够保持良好的乳房外形的早期乳腺癌患者。对于多灶性乳腺癌(同一个象限的多个病灶),也可尝试进行保乳手术。
7.1.2.2 临床Ⅲ期患者(炎性乳腺癌除外)
经术前治疗降期后达到保乳手术标准时也可以慎重考虑。
7.1.3 保乳治疗的绝对禁忌证
⑴ 妊娠期间放疗。对于妊娠期妇女,保乳手术可以在妊娠期完成,而放疗可以在分娩后进行。
⑵ 病变广泛,且难以达到切缘阴性或理想保乳外型。
⑶ 弥漫分布的恶性特征钙化灶。
⑷ 肿瘤经局部广泛切除后切缘阳性,再次切除后仍不能保证病理切缘阴性者。
⑸ 患者拒绝行保留乳房手术。
⑹ 炎性乳腺癌。
7.1.4 含以下因素时应谨慎考虑行保乳手术
⑴ 活动性结缔组织病,尤其硬皮病和系统性红斑狼疮或胶原血管疾病患者,对放疗耐受性差。
⑵ 同侧乳房既往接受过乳腺或胸壁放疗者,需获知放疗剂量及放疗野范围。
⑶ 肿瘤直径>5 cm等肿瘤与乳房体积比值较大者,易出现满意外型与充分切缘之间的矛盾。
⑷ 多中心病灶(多中心病灶指在2个或2个以上象限存在1个及以上病灶,或病理学类型和分子分型完全不一样的2个乳腺病灶)。
⑸ 侵犯乳头(如乳头Paget病)。
⑹ 切缘接近,墨染切缘与肿瘤的距离<2 mm时(浸润性癌,除外表面、基底等不可能再次补充切除者)。对“切缘接近”的具体标准目前仍然缺乏共识,多数专家倾向于认可切缘距离肿瘤2 mm可能影响保乳患者的局控。
⑺ 已知乳腺癌遗传易感性强(如BRCA1/2基因突变),保乳后同侧乳房复发风险增加的患者。
7.1.5 保乳治疗前的谈话
⑴ 经大样本临床试验证实,早期乳腺癌患者接受保乳治疗和全乳切除治疗后生存率及远处转移的发生率相似。
⑵ 保乳治疗包括保乳手术和术后的辅助放疗,其中保乳手术包括肿瘤的局部广泛切除及ALND或SLNB。
⑶ 术后全身性辅助治疗基本上与乳房切除术相同,但因需配合辅助放疗,可能需要增加相关治疗的费用和时间。
⑷ 同样病期的乳腺癌,保乳治疗和乳房切除术后均有一定的局部复发率,前者5年局部复发率为2%~3%(含第二原发乳腺癌),后者约为1%,不同亚型和年龄的患者有不同的复发和再发乳腺癌的风险。保乳治疗患者一旦出现患侧乳房复发仍可接受补救性全乳切除术±乳房重建,并仍可获得较好的疗效。
⑸ 保留乳房治疗可能会影响原乳房的外形,影响程度因肿块的大小和位置而异;肿瘤整复技术可能改善保乳手术后的乳房外形和对称性。
⑹ 虽然术前已选择保乳手术,但医师手术时有可能根据具体情况更改为全乳切除术(如术中或术后病理学检查报告切缘阳性,当再次扩大切除已经达不到预期美容效果的要求,或再次切除切缘仍为阳性时),应告知患者即刻或延期乳房再造的相关信息。术后石蜡包埋组织切片病理学检查如切缘为阳性则可能需要二次手术。
⑺ 有乳腺癌家族史或乳腺癌遗传易感(如BRCA1、BRCA2或其他基因突变)者,有相对高的同侧乳腺癌复发或对侧乳腺癌再发风险。
7.1.6 保乳手术
7.1.6.1 术前准备
⑴ 乳房的影像学评估,包括双侧乳腺X线和乳房超声检查(对绝经前、致密型乳腺者,在有条件的中心,可考虑行乳房增强MRI检查)。
⑵ 签署知情同意书。
⑶ 推荐在术前行病灶的穿刺活检,有利于与患者讨论术式的选择及手术切除的范围。空芯针活检前应与活检医师密切协商沟通,选取合适的穿刺点,以确保术中肿瘤和穿刺针道的完整切除。没有确诊时,患者可能心存侥幸,不能正确、严肃地考虑保乳和SLNB的优缺点,容易在术后表现出对手术方式和复发风险的不信任。另外,术前行病灶的穿刺活检可以避免外上象限肿块切除活检对腋窝SLNB的影响。
⑷ 体检不能触及病灶者应在手术前行X线、MRI或超声下病灶定位,必要时应在活检部位放置定位标记。
⑸ 麻醉方式宜采用全麻。
⑹ 新辅助治疗后保乳患者,新辅助治疗前可通过影像引导(常用超声)在病灶中心或病灶边缘处放置钛夹,有助于寻找手术区域、病理标本的取材;新辅助治疗后残留病灶较小临床无法触及时推荐通过影像引导下导丝定位或染料标识后行手术切除。
⑺ 其余术前准备同乳腺肿瘤常规手术。目前对保乳手术前乳腺MRI的价值仍存在一定争议,现有研究结果表明其并不能够降低局部复发风险,对远期生存率无影响,未能降低再手术率,且同时增加了全乳切除率。推荐术前,尤其针对腺体致密型患者行MRI检查。MRI的优势包括:①更全面地掌握乳房的解剖特征,如腺体脂肪比例、皮下脂肪厚度、胸壁结构、腋窝等信息;②更为准确地评估病灶的位置、形态、累及范围、与周围结构的关系,评估乳头乳晕区域是否受累等情况;③ 对多灶多中心病变有更高的敏感性;④ 能检出临床触诊阴性以及对侧乳房的可 疑病灶,并能够引导穿刺活检;⑤ 评估内乳淋巴结情况。
7.1.6.2 手术过程
⑴ 一般建议乳房和腋窝各取一切口,若肿瘤位于乳腺尾部,也可采用一个切口。切口可根据肿瘤部位、乳房大小和下垂度及肿瘤整复技术的需要来选择。推荐选择符合皮肤自然纹理(langers线)的肿物表面切口。肿瘤位于上象限时,可通过采用弧形切口切除肿瘤,并获得较为理想的术后外形。肿瘤位于下象限时,可使用放射状切口切除肿瘤。在少数情况下,保乳手术的切口设计还需兼顾腋窝区域淋巴结的处理。当肿瘤位于外上象限或乳房近腋窝处时,可考虑采取弧形切口以便在切除肿瘤的同时,对腋窝淋巴结进行活检或清扫。目前肿瘤整形技术发展迅速,切口的选择也愈发多样化,例如双环切口、蝙蝠翼切口、J形切口等个体化设计切口。就术后局部复发率而言,肿瘤整形技术与传统保乳手术相当。肿瘤表面皮肤可不切除或仅切除小片。如果肿瘤侵犯Cooper韧带,需考虑切除凹陷皮肤。
⑵ 乳房原发灶切除范围应包括肿瘤、肿瘤周围一定范围的乳腺组织,并根据肿瘤位置和乳腺厚度决定是否切除部分皮下组织及肿瘤深部的胸大肌筋膜。活检穿刺针道、活检残腔及活检切口皮肤瘢痕应尽量包括在切除范围内。肿瘤与乳房体积比值较大、需要切除组织量较大时,特殊部位的乳腺肿瘤,乳房过大和(或)中-重度下垂时,可联合采用肿瘤整复技术,以改善术后乳房外观。乳腺肿瘤整形手术(oncoplastic surgery,OPS)是将肿瘤外科技术和整形外科技术整合,在切除肿瘤并确保切缘阴性的情况下,修复乳房外形的外科技术。Clough通过预估切除腺体体积将保乳整形手术分为两种类型。Ⅰ型切除体积<20%,通过简单的手术方式—通常是游离腺体,能够修复乳房外观。Ⅱ型切除体积20%~50%,需要较复杂的技术恢复外观,不同象限的手术采取不同的技术。保乳整形手术的方法分为容积移位和容积替代两大类。容积移位技术是在部分乳房切除术后应用剩余的乳腺腺体移位来填充肿瘤切除后的残腔,从而达到塑形和美容的效果。容积替代技术是应用腺体以外的自体组织来填充残腔以达到美容的目的。新辅助治疗后保乳的患者,可根据新辅助治疗后肿块的范围予以切除,并推荐由经验丰富的多学科协作团队实施,推荐在术前进行精确的影像学评估。中-重度下垂、体积较大的乳房是保乳整形手术的适应证,可以根据患者需求同期或分期行健侧乳房对称性塑形手术。
⑶ 对乳房原发灶手术切除的标本进行上、下、内、外、表面及基底等方向的标记。包含钙化灶的保乳手术时,术中应对标本行X线摄片,以明确病灶是否被完全切除及病灶与各切缘的位置关系。
⑷ 对标本各切缘进行评估(如切缘染色或术中快速冷冻切片及印片细胞学检查),术后需要石蜡包埋组织切片的病理学检查以明确诊断。
⑸ 乳房手术残腔止血、清洗,推荐放置惰性金属夹(如钛夹)作为放疗瘤床加量照射时的定位标记(术前告知患者),以便于术后影像随访。建议在各切缘放置钛夹,尽可能在上、下、内、外、基底各放置1枚,上、下、内、外切缘的钛夹应放置在腺体基底与表面之间距离的1/2处。逐层缝合皮下组织和皮肤。
⑹ 腋窝淋巴结处理:腋窝淋巴结临床阴性者行SLNB,根据活检结果决定是否进行ALND;腋窝淋巴结临床阳性者直接行ALND。
⑺ 若术中或术后病理学检查报告切缘阳性,可行全乳切除,或尝试扩大局部切除范围以达到切缘阴性。虽然对再切除的次数没有严格限制,但当再次扩大切除已经达不到美容效果的要求或再次切除切缘仍为阳性时,建议改为全乳切除。
7.1.6.3 术后病理学检查
⑴ 病灶切缘的大体检查和镜下切缘距离测量,推荐同时报告最近切缘的方向、距离和肿瘤的类型。
⑵ 其他同常规病理学检查。
⑶ 术后病理学检查报告提示切缘上存在多形性小叶原位癌、DCIS时,建议行进一步广泛切除手术,以保证切缘阴性。暂不建议通过局部放疗予以替代。
7.1.6.4 随访和局部复发
保乳术后复发的时间及模式与全乳切除术后存在差异,保乳手术后可能会出现局部、区域复发及远处转移,其中术后的局部复发,包括在同侧被保留的乳房内再次出现病灶和(或)区域复发[肿瘤累及同侧区域淋巴结,通常见于同侧腋窝或锁骨上淋巴结,少数位于锁骨下和(或)内乳淋巴结]。因此术后复发监测和随访策略应该根据患者的手术类型综合考量来确定。在保乳术后复发的高峰期内进行更频繁的监测随访可能有助于早期发现术后复发。除常规超声检查随访外,保乳患者术后推荐每年1次行钼靶X线(必要时MRI)影像学随访。
术后局部复发率,每年0.6%~1.5%。近年来,保乳治疗的5年局部区域复发率呈现出下降的趋势。在保乳手术和现代全身治疗以及放疗后,总的5年局部复发率为4.2%。未经新辅助治疗的保乳手术局部复发危险因素包括年龄、分子分型、淋巴结状况、切缘状态以及系统性治疗的规范性等。
乳腺癌保乳手术后的局部复发(local recurrence,LR)包括乳房内复发、皮肤及胸壁的复发,复发的方式有两种:一种是癌前病变或亚临床病灶的癌细胞未被手术或放疗清除所导致的真性复发(ture recurrence,TR);另一种是出现了组织学类型或肿瘤部位不同于第一原发癌的新病灶(new primary,NP),即第二原发癌。这两种复发方式对预后的影响是不同的,发生真性复发会缩短患者的生存时间,真性复发距第一次手术时间越近、预后越差。要根据复发方式及复发间期采取不同的治疗方式,除局部手术外,还需结合病理学分型给予全身系统性治疗。同侧乳房复发后可采取以下手术处理方式:补救性全乳房切除联合或不联合放疗(可联合乳房整形及重建手术)、二次保乳联合或不联合放疗。对于保乳手术及术后放疗后无病间期较长(>5年),同侧乳腺内复发或第二原发肿瘤,如条件允许专家组推荐可行再次保乳,直接腋窝清扫或者再次行SLNB都是可选的腋窝评估方式。
7.2 保乳标本的病理学检查取材规范
保乳标本切缘取材主要包括两种方法:垂直切缘放射状取材和切缘离断取材,详见第六章节,两种切缘取材方法各有优缺点。无论采取何种取材方法,建议在取材前将标本切缘涂上染料,以便在镜下观察时能对切缘作出准确定位,并正确测量肿瘤与切缘的距离。保乳标本病理学检查报告中需明确记述切缘状态(阳性或阴性)。对于Ⅰ、Ⅱ期浸润性癌保乳手术后行全乳放疗的患者,美国肿瘤外科和放疗学会建议“墨染切缘处无肿瘤”为阴性切缘。对DCIS保乳手术后行全乳放疗的患者,切缘与肿瘤的距离达到2 mm,同侧乳房肿瘤复发率显著降低,即使有少量肿瘤的残留,也可通过后续全乳放疗得到控制,更宽的切缘并不能使复发风险显著降低。美国肿瘤外科、放疗和肿瘤内科学会联合颁布的“接受全乳放疗的DCIS保乳切缘指南”建议墨染切缘距肿瘤2 mm为安全距离。对于切缘阴性者,建议报告切缘与肿瘤的距离,应尽量用客观定量描述,而不建议用主观描述(如距切缘近等)。阴性切缘不一定代表剩余乳腺组织内无癌细胞,而意味着残余肿瘤可以被全乳放疗有效地控制。
阳性切缘是指墨染切缘处有DCIS或浸润性癌侵犯。切缘DCIS累及的范围可分为三类:①局灶侵犯:切缘上DCIS累及范围最大径小于1 mm,局限于1个蜡块;②轻-中度侵犯:切缘上DCIS累及范围介于局灶和广泛侵犯之间;③广泛侵犯:切缘上DCIS累及范围≥15 mm,或在5个及以上高倍视野中切缘观察到DCIS,或在8个及以上蜡块的切缘中观察到DCIS。
7.3 乳腺癌保乳术后的放疗
7.3.1 全乳放疗
7.3.1.1 适应证
原则上接受保留乳房手术的患者均需要接受放射治疗。但是,对于同时满足以下特定条件的患者,即符合CALGB9343与PRIMEⅡ两项研究的入组条件,权衡放射治疗的绝对和相对获益,充分考虑患者的方便程度、全身伴随疾病及患者意愿,可以考虑豁免放疗。
⑴ 患者年龄≥70岁。
⑵ 病理学分期为T1N0M0。
⑶ 激素受体阳性。
⑷ 切缘阴性且可以接受规范的内分泌治疗的患者。
7.3.1.2 与全身系统性治疗的时序配合
无辅助化疗指征的患者术后放疗建议在手术后8周内进行。由于术后早期术腔体积存在动态变化,尤其是含有术腔血肿的患者,所以不推荐术后4周内开始放疗。接受辅助化疗的患者应在末次化疗后2~4周内开始。关于内分泌治疗与放疗的时序配合目前没有一致意见,可以同期或在放疗后开展。曲妥珠单抗治疗患者只要放疗前心功能正常,可以与放疗同时使用。卡培他滨已被用于维持治疗及新辅助化疗后的强化治疗中,但辅助放疗期间是否可以同期用卡培他滨,目前仍缺乏有效证据。
7.3.1.3 照射靶区
①ALND或SLNB阴性的患者照射靶区只需包括患侧乳腺;②ALND后有转移的患者,照射靶区除患侧乳腺外,原则上还需要包括乳腺及区域淋巴引流区;③前哨淋巴结(sentinel lymph node,SLN)1~2枚转移[微转移和(或)宏转移],如果未行ALND。根据Z0011与AMAROUS等临床研究结果,可以考虑高位切线野照射(切线野上界位于肱骨头下2 cm以内),具体范围包括低位腋窝的Ⅰ/Ⅱ组,或包含腋窝三组及锁骨上内侧组淋巴引流区照射。其中,对于宏转移的患者,更倾向于腋窝三组及锁骨上内侧组淋巴引流区照射。④靶区勾画定义参考RTOG/ESTRO勾画共识,或复旦大学附属肿瘤医院《早期乳腺癌术后靶区勾画共识》。
7.3.1.4 照射技术
⑴ 常规放疗技术:X线模拟机下直接设野,基本射野为乳房内切野和外切野。内界和外界需要各超过腺体1 cm,上界一般在锁骨头下缘,或与锁骨上野衔接,下界在乳房皱褶下1~2 cm。一般后界包括不超过2.5 cm的肺组织,前界皮肤开放,留出1.5~2.0 cm的空隙以避免因摆位误差、呼吸运动以及治疗过程中乳腺肿胀造成的靶区漏照射;同时各个边界需要根据病灶具体部位进行调整,以保证瘤床处剂量充足。
⑵ 射线和剂量分割:原则上采用直线加速器6 MV X线,全乳照射剂量45.0~50.0 Gy,1.8~2.0 Gy/次,5次/周。通常采用直线加速器6 MV X线,全乳常规分割放疗照射剂量为45.0~50.4 Gy/25~28次,1.8~2.0 Gy/次,每周5次;或采用大分割放射治疗40.0~42.5 Gy/15~16次,2.66 Gy/次,每周5次。中国医学科学院肿瘤医院大分割方案为43.5 Gy/15次,2.9 Gy/次,每周5次。
⑶ 瘤床加量:大部分保乳术后患者在全乳照射基础上均可通过瘤床加量进一步提高局部控制率。全乳照射后序贯瘤床加量可以进一步降低局部复发率,对于低危复发患者可以不考虑加量。瘤床加量剂量通常为10.0~16.0 Gy/4~8次,2.0~2.5 Gy/次。瘤床加量可以用电子线照射,瘤床位置深的患者建议采用光子线的三维适形技术。国内有条件的单位也可以开展术中X线、电子线或近距离后装技术加量。
⑷ 三维适形和调强照射技术:有条件的单位,尽可能不要采用二维放疗技术,建议采用计算机体层成像(computed tomography,CT)定位。三维适形或正向调强的野中野技术是目前乳腺癌乳房照射的标准技术。对于心脏和肺的照射剂量高,胸廓形状特殊的患者逆向调强技术优于三维适形或正向调强,有条件的单位可以采用逆向调强放疗技术。具备相应条件的单位也可以采用基于深吸气条件下的呼吸门控技术或者俯卧位照射技术,以进一步降低心脏和肺的照射剂量。
⑸ 区域淋巴结放疗技术见第9章乳腺癌全乳切除术后放疗临床指南。
7.3.2 部分乳腺短程照射(accelerated partial breast irradiation,APBI)
7.3.2.1 适应证
保乳术后APBI可能获得与标准的全乳放疗相当的局部控制率。APBI的优势在于可减少乳腺以及临近正常组织的照射体积,缩短治疗时间。同时接受APBI治疗的患者在局部复发率方面不应低于接受全乳放疗的患者。已经发表的或公开报告的多项Ⅲ期临床研究结果显示,APBI在局部控制率以及美容效果方面有一些冲突的结果。因此,接受APBI治疗的患者仍然需要严格选择,对于符合美国肿瘤放射治疗协会(American Society of Radiation Oncology,ASTRO)2016年共识的低危人群可以考虑部分乳房照射,标准如下:
⑴ 年龄≥50岁。
⑵ 无BRCA1/2基因突变。
⑶ 病理学检查确诊为T1N0M0。
⑷ 单中心单病灶。
⑸ 未接受新辅助治疗。
⑹ 至少2 mm阴性切缘。
⑺ 无LVI。
⑻ 无广泛DCIS成分。
⑼ 激素受体阳性的浸润性导管癌或其他预后良好乳腺癌。
⑽ 或纯的DCIS,满足以下条件:筛查发现的;低中分级;直径≤2.5 cm;阴性切缘≥3 mm。
7.3.2.2 技术选择
临床应用的部分乳房照射技术包括:
⑴ 外照射技术:三维适形以及调强放射治疗技术。外照射技术常见的方案包括:38.5 Gy/10次,每天2次,间隔大于6 h;或40.0 Gy/15次,每天1次;30 Gy/5次,隔日1次。最近的临床试验结果表明,无论选用那种外照射技术,同侧乳房复发与全乳放疗相当。因此,支持外照射在APBI中应用。但鉴于加拿大RAPID研究美容效果的报告,38.5 Gy/10次,每天2次的方案也需要慎重。
⑵ 术中照射技术:包括术中放疗,组织间插植和球囊导管。术中放疗包括千伏X线、电子线两种技术。根据最近的临床试验结果,大部分术中放疗技术的同侧乳房复发风险高于全乳放疗组,因此,需要谨慎选择合适患者。
8
乳腺癌前哨淋巴结活检临床指南
循证医学Ⅰ级证据证实,乳腺癌SLNB是一项评估腋窝分期的活检技术,可准确地评价腋窝淋巴结的病理学状态,对于腋窝淋巴结阴性的患者,可安全有效地替代ALND,从而显著减少手术的并发症,改善患者的生活质量;对于SLN 1~2枚转移的患者,亦可有条件地安全替代ALND。此外,新辅助治疗前后的SLNB也受到越来越多的关注。
乳腺癌SLNB的流程包括适应证的选择,示踪剂的注射和术前淋巴显像,术中SLN的检出,SLN的术中及术后组织学、细胞学和分子病理学诊断,SLN阳性患者的腋窝处理及SLN阴性替代ALND患者的术后随访等。
8.1 开展SLNB的必要条件
8.1.1 多学科协作
SLNB需要外科、影像科、核医学科和病理科等多学科的团队协作。开展SLNB的医疗单位应该尽量具备相关的技术和设备条件。由于SLN 1~2枚转移及新辅助治疗后腋窝降期患者可以有条件地免除ALND,因此也需要肿瘤内科和放疗科医师加入到SLNB的多学科协作团队中来。
8.1.2 学习曲线
完整的学习曲线对于提高SLNB的成功率、降低SLNB的假阴性率非常重要。开展SLNB替代ALND的医疗单位必须通过资料收集和结果分析,以确保整个团队熟练掌握SLNB技术。目前,建议在采用SLNB替代ALND前,应完成一定数量(如40例以上)的SLNB和ALND一致性的研究病例,使SLNB的成功率达到90%以上,假阴性率低于10%。
8.1.3 知情同意
患者术前应在充分了解SLNB的成功率、假阴性率及相关的复发风险之后,自愿接受SLNB替代ALND,并且理解在SLN检出失败时需进行常规ALND。
8.2 SLNB指征
SLNB是早期浸润性乳腺癌的标准腋窝分期手段,具体适应证见表1。随着乳腺癌SLNB研究的不断深入,越来越多的相对禁忌证已逐渐转化为适应证。目前认为,可手术乳腺癌患者SLNB的禁忌证仅包括炎性乳腺癌、临床查体腋窝淋巴结阳性并经穿刺证实为转移且未接受新辅助治疗及腋窝淋巴结阳性新辅助治疗后仍为阳性的患者,cN2-3新辅助治疗后腋窝淋巴结临床阴性患者SLNB的准确性和安全性仍有待验证。腋窝淋巴结阳性和阴性患者均可进行内乳SLNB。
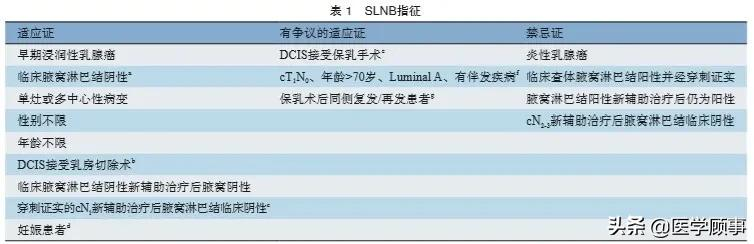
a:临床查体和影像学检查可疑的腋窝淋巴结可以通过超声引导下的细针穿刺或空芯针活检进行评估,细胞学或病理组织学阴性患者仍可进入SLNB流程;b:切除活检不存在DCIS升级为浸润性癌时可以免除SLNB;c:必须符合新辅助治疗前穿刺阳性淋巴结放置标记、采用双示踪方式、包括标记淋巴结在内的前哨淋巴结;d:核素示踪剂SLNB对胎儿的安全性已经获得证实,由于可能的过敏性不推荐使用蓝染料示踪剂;e:乳腺原发肿瘤的切除如果不影响到随后SLND的成功率和准确性可以不进行同期SLNB;f:若不行SLNB,可豁免前哨,不做腋窝处理;g:保乳手术联合SLNB术后同侧乳房复发/再发患者再次SLNB的准确性和安全性已获得初步认可;注:虽然综合2021版NCCN指南、2021版加拿大安大略及ASCO前哨淋巴结活检指南,“临床腋窝淋巴结阴性、影像1~2枚淋巴结异常并穿刺阳性”患者可能可以尝试前哨淋巴结活检,但是国内专家团的投票认同率不高。
8.3 SLNB操作规范
8.3.1 示踪剂
乳腺癌SLNB的示踪剂包括蓝染料和核素示踪剂。首先推荐联合使用蓝染料和核素示踪剂,可以使SLNB的成功率提高、假阴性率降低。荧光示踪技术可作为可选的前哨示踪技术。纳米碳作为示踪剂的价值有待进一步证实。经过严格的学习曲线和熟练操作后,也可以单用蓝染料或核素示踪剂。
⑴ 蓝染料:国外较多使用专利蓝和异硫蓝,国内较多使用亚甲蓝(美兰),示踪用米托蒽醌示踪剂的成功率、准确性和安全性获得Ⅲ期临床试验证实。上述蓝染料示踪剂具有相似的成功率和假阴性率。
⑵ 核素示踪剂:推荐使用的是99mTc标记的硫胶体,要求煮沸5~10 min,标记率大于90%,标记核素强度(0.5~1.0)mCi/(0.5~2.0)mL。是否采用220 nm滤网过滤标记的硫胶体并不影响SLNB的成功率和假阴性率。核素示踪剂对患者、胎儿及医务人员均是安全的,不需要特别防护。
⑶ 注射部位:蓝染料和核素示踪剂注射于肿瘤表面的皮内或皮下、乳晕区皮内或皮下及原发肿瘤周围的乳腺实质内均有相似的成功率和假阴性率。如进行内乳区SLNB,需采用核素示踪剂、适当增加示踪剂并在超声引导下确保其注射于乳晕周围较厚的乳腺腺体层内。
⑷ 注射时间:核素示踪剂的注射时间一般要求术前3~18 h,采用皮内注射可以缩短到术前30 min。蓝染料示踪剂术前10~15 min注射。
⑸ 术前淋巴显像:乳腺癌SLNB术前可行淋巴显像,有助于确定腋窝以外的SLN、特别是保乳术后同侧复发/再发患者再次SLNB,但术前淋巴显像对于初次腋窝SLN的完全检出并非必需。
8.3.2 SLN术中确认与检出
无论是乳房切除手术,还是保乳手术,一般情况下,SLNB应先于乳房手术,特别是单用蓝染料示踪剂时。术中SLN的确定因示踪剂而异,染料法要求检出所有蓝染淋巴管进入的第1个蓝染淋巴结,仔细检出所有蓝染的淋巴管是避免遗漏SLN、降低假阴性率的关键。核素法SLN的阈值是超过淋巴结最高计数10%以上的所有淋巴结,术中γ探测仪探头要缓慢移动,有序检测,贴近计数。应用染料法和(或)核素法检出SLN后,应对腋窝区进行触诊,触诊发现的肿大质硬淋巴结也应作为SLN单独送检。
8.4 SLN的病理组织学、细胞学和分子生物学诊断
8.4.1 SLN的术中诊断
准确、快速的SLN术中诊断可以使SLN阳性患者通过一次手术完成ALND,避免二次手术的费用负担和手术风险。推荐使用冷冻快速病理组织学和(或)印片细胞学作为SLN术中诊断的检测方法。专家投票团对一步核酸扩增(OSNA)技术术中检测SLN的价值尚缺乏一致性认同。
由于1~2枚SLN阳性患者可以有条件地避免ALND,SLN术中诊断的必要性有所降低。多数专家认为符合避免ALND条件的患者可以考虑不行SLN术中诊断,但进行术中评估也是合理的选择。
8.4.2 SLN的术后诊断
SLN术后病理组织学诊断的金标准是逐层切片病理学检查,建议所有单位对SLN进行规范化取材。推荐将SLN沿长轴切分成2 mm厚的组织块。不推荐常规应用免疫组织化学技术以提高SLN微小转移灶的检出。
8.5 SLN转移灶类型判定标准、预后意义及临床处理
8.5.1 SLN转移灶类型判定标准[AJCC(第8版)乳腺癌TNM分期]
转移灶的位置不影响宏转移、微转移及ITC的诊断。转移灶可以位于淋巴结内、突破被膜或淋巴结外脂肪侵犯;转移灶伴纤维间质反应时,转移灶大小应为肿瘤细胞和相连纤维化病变的长径。
⑴ 宏转移:淋巴结内存在1个以上>2 mm肿瘤病灶;仅有ITC的淋巴结不作为pN分期阳性淋巴结,但应另外记录为ITC。仅依据SLNB分期或SLN加非前哨淋巴结(non SLN,nSLN)<6个,加标记(sn),如pN1(sn);SLN≥6个,不再另加标记(sn)。不推荐可能含有宏转移的淋巴结接受分子诊断等其他的试验或替代检测,其可能使常规病理学诊断漏诊宏转移;如果使用,应予登记。
⑵ 微转移:肿瘤病灶最大径大于0.2 mm,但≤2.0 mm,或单张组织切片不连续,或接近连续的细胞簇≥200个细胞。记录只发现微转移(无宏转移)的淋巴结数目,标记为pN1mi或pN1mi(sn);多个转移灶时,测量最大转移灶的最大径,不能累计。
⑶ ITC:单个细胞或最大径≤0.2 mm的小细胞簇;单张组织切片不连续或接近连续的细胞簇<200个细胞,淋巴结不同纵/横切片或不同组织块不能累计计数;通常没有或很少组织学间质反应;可通过常规组织学或免疫组织化学法检出。记录ITC受累淋巴结数目,标记为pN0(i+)或pN0(i+)(sn);使用分子生物学技术(实时定量PCR)检出组织学阴性淋巴结的微小转移灶,标记为pN0(mol+)。
8.5.2 SLN不同转移类型的预后意义及腋窝处理
⑴ 宏转移:约30%的患者腋窝nSLN阳性。ALND是标准处理之一,特别是通过ALND进一步获得的预后资料将改变治疗决策。对于未接受过新辅助治疗的临床T1-2期、临床腋窝淋巴结为阴性、病理学检查1~2枚SLN宏转移且会接受后续进一步辅助全乳放疗及全身系统性治疗的保乳患者,可免除ALND。对于接受乳房切除术的1~2枚SLN宏转移患者,如果ALND获得的预后资料不改变治疗决策且患者同意不行ALND,腋窝放疗可以作为ALND的合理替代。
⑵ 微转移:13%~20%的患者腋窝nSLN阳性,且约10%为宏转移,ALND可导致15%的患者分期提高,7%的患者辅助治疗改变。SLN微转移患者接受保乳治疗(联合全乳放疗)时,可不施行ALND;SLN微转移且后续仅行全乳切除未放疗时,大多数中国专家的意见倾向于腋窝处理同宏转移患者。
⑶ ITC:腋窝nSLN转移的概率小于8%(大于5 mm的浸润性导管癌),ALND可导致4%的患者分期提高。目前认为ITC对患者预后有不良影响,与微转移患者一样可以通过辅助全身治疗获益,但ITC患者不接受腋窝治疗其腋窝复发率并无显著升高,故不推荐常规施行ALND。
⑷ 初始SLN阴性:无需进行腋窝处理。
⑸ 新辅助治疗:
①初始临床腋窝淋巴结阴性患者:SLN阴性患者可以避免ALND及区域放疗;SLN阳性,包括宏转移、微转移及ITC患者,ALND仍是标准治疗;新辅治疗前1枚SLN宏转移、微转移及ITC患者,可以考虑腋窝放疗替代ALND。新辅助治疗前还是治疗后实施SLNB,两种方式在SLN检出率、准确性、手术次数、对初始疾病分期的确切性上各有利弊,推荐首选新辅助治疗后SLNB。对于新辅助治疗前行SLNB,病理学检查证实SLN为阴性的患者,新辅助治疗后如临床淋巴结阴性则不再手术评估腋窝状态;新辅助治疗前行SLNB并且病理学检查确认为1~2枚阳性SLN的临床T1-2期乳腺癌、新辅助治疗有效且计划接受保乳术后全乳放疗或乳房切除术后腋窝放疗的患者,可以考虑免除ALND;新辅助治疗前SLNB检出3枚及以上阳性SLN的患者,ALND是标准的腋窝处理。不推荐新辅助治疗前、后进行两次SLNB。②初始临床腋窝淋巴结阳性患者:并非所有临床淋巴结阳性的患者都适合新辅助治疗降期后的SLNB,临床淋巴结分期为cN2期及以上的患者新辅助治疗后淋巴结活检有效性尚缺乏大样本量的研究。对于新辅助治疗前cN1期的患者,更适合通过新辅助治疗降期保腋窝。满足以下条件的SLN阴性患者,经与患者充分沟通后可以避免ALND:cT1-3N1期,双示踪剂显像,检出≥3枚SLN,新辅助化疗前穿刺活检阳性的腋窝淋巴结放置标记夹并于术中检出。如新辅助治疗后行SLNB并确认为阴性(ypN0),大多数专家目前仍推荐术后对腋窝Ⅰ、Ⅱ群范围予以辅助放疗;若经穿刺证实cN1患者新辅助治疗后SLN病理组织学检查证实转移(包括宏转移、微转移及ITC),应行ALND。经穿刺证实的cN1、新辅助治疗无效患者,ALND仍是最佳的选择。
8.6 SLNB替代ALND患者的随访
除常规复查项目外,常规行双侧腋窝、锁骨区超声检查,有条件的可考虑MRI检查。临床或超声检查发现异常腋窝淋巴结,应在超声引导下行细针穿刺或空芯针活检,必要时行切开活检手术。
9
乳腺癌全乳切除术后放疗临床指南
9.1 适应证
全乳切除术后放疗可以使腋窝淋巴结阳性患者的5年局部-区域复发率降低到原来的1/4~1/3。全乳切除术后,如具有下列预后因素之一,则符合高危复发,具有术后放疗指征,该放疗指征与全乳切除的具体手术方式无关:
⑴ 原发肿瘤最大直径≥5 cm,或肿瘤侵及乳房皮肤、胸壁。
⑵ 腋窝淋巴结转移≥4枚。
⑶ 淋巴结转移1~3枚的T1-2期,现有证据支持术后放疗可降低局部复发率、任何部位的复发及乳腺癌相关死亡,然而对低危亚组需权衡放疗获益和风险。术后放疗可能在存在以下情况的患者中更有意义:年龄≤40岁,ALND数目<10枚时转移比例>20%,激素受体阴性,HER2过表达,组织学分级高,以及LVI阳性等。对于合并存在多个低危复发的因素的患者,如老年,肿瘤大小为T1,脉管癌栓阴性,1枚或少量淋巴结转移(如淋巴结微转移或ITC),组织学分级低,激素受体强阳性及有限生存期等,需要在充分告知患者术后放疗的获益、治疗风险及并发症之后可考虑免除局部放疗。
⑷ T1-2期乳腺单纯切除联合SLNB,如SLN阳性,在不考虑后续腋窝清扫时,推荐术后放疗;如不考虑放疗,则推荐进一步腋窝清扫。
9.2 与全身治疗的时序配合
具有全乳切除术后放疗指征的患者一般都具有辅助化疗适应证,所以术后放疗应在完成末次化疗后2~4周内开始。个别有辅助化疗禁忌证的患者可以在术后切口愈合、上肢功能恢复后开始放疗。内分泌治疗与放疗的时序配合目前没有明确共识,可以在放疗同期或放疗后开始。HER2阳性患者有靶向药物治疗指征者,如曲妥珠单抗等在放疗前评估心功能正常则靶向药物可以与放疗同期使用;同时对于接受靶向治疗的左侧患者内乳区放疗适应证应严格掌握,尽可能采用三维治疗技术以降低心脏照射体积,评估心脏照射平均剂量尽量低于6 Gy。
9.3 照射靶区
⑴ 由于胸壁和锁骨上是全乳切除术后最常见的复发部位,约占所有复发部位的80%,所以这两个区域是术后放疗的主要靶区;但病理学分期为T3N0的患者可以考虑单纯胸壁照射,免除区域淋巴结放疗作为个体化处理。
⑵ 内乳放疗适应证仍有争议,术中内乳淋巴结活检的研究显示,内乳淋巴结阳性率根据肿瘤所在象限不同为10%~40%,但全身系统性治疗后内乳淋巴结复发率小于5%,最近的前瞻性多中心术后辅助放疗的研究都将内乳野纳入治疗靶区,结果显示局部和长期生存获益。因此,对于治疗前影像学诊断内乳淋巴结转移可能性较大或经术中快速冷冻切片病理学检查证实为内乳淋巴结转移的患者,抑或原发肿瘤位于内侧象限同时腋窝淋巴结有转移或其他内乳淋巴结转移概率较高的患者,推荐内乳野照射。原则上对于HER2过表达的患者为避免抗HER2治疗和内乳照射心脏毒性的叠加,推荐采用三维治疗技术,尽可能降低心脏受照平均剂量。
9.4 照射剂量和照射技术
全乳切除术后放疗靶区的常规放疗剂量为50.0 Gy/25次(2.0 Gy/次),对于影像学(包括功能性影像)上高度怀疑有残留或复发病灶的区域可局部加量至60.0~66.0 Gy。
乳腺癌大分割放疗临床研究数据显示,大分割放疗在局部控制、生存及不良反应各方面都与常规放疗相似,因此,对于全乳切除术后的分次放疗剂量在常规剂量的2.0 Gy/次以外,可推荐采用中等程度的分次大分割剂量,即分次剂量为2.5 Gy~3.0 Gy,但最终的放疗总剂量应等效于常规放疗2.0 Gy/次时的总剂量,即50.0 Gy。
9.4.1 三维适形照射技术
与常规二维治疗相比,基于CT定位的三维治疗计划可以显著地提高靶区剂量均匀性和减少正常组织不必要的照射,提高射野衔接处剂量的合理性,因此在医疗软件和硬件许可的情况下,首先推荐采用三维治疗计划和照射技术。可采用的计划类型包括三维适形放疗(3-dimensional conformal radiation therapy,3D-CRT)和适形调强放射治疗(intensitymodulated radiation therapy,IMRT)。调强技术设计包括正向调强、逆向调强及容积弧形调强技术,有条件的单位在计划和治疗时可加入呼吸控制技术-主动呼吸门控或被动呼吸控制,以进一步提高靶区治疗的精确性和降低正常组织的照射剂量。胸壁和区域淋巴结靶区勾画可以参照美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)和(或)欧洲放射肿瘤学会(European Society Therapeutic Radiation Oncology,ESTRO)勾画指南。正常组织的勾画包括脊髓、双侧肺部、心脏及肱骨头等,后续需要在治疗计划中评估正常组织的照射剂量。如果采用逆向优化计划或容积弧形调强计划(Arc计划),需注意控制照射野的角度,尽量避免对侧乳腺和其他正常组织不必要的照射。如选择常规定位(二维定位),也建议定位后在定位CT上扫描并在三维治疗计划系统上进行剂量参考点的优化、楔形滤片角度的选择和正常组织体积剂量的评估等,以更好地达到靶区剂量的完整覆盖和放射损伤的降低。
9.4.2 常规照射技术
⑴ 锁骨上/下野:上界为环甲膜水平,下界位 于锁骨头下1 cm与胸壁野上界相接,内界为胸骨切迹中点沿胸锁乳突肌内缘向上,外界与肱骨头相接,照射野需包括完整的锁骨。可采用X线和电子线混合照射以减少肺尖的照射剂量。治疗时头部偏向健侧以减少喉照射,机架角向健侧偏斜10°~15°以保护气管、食管和脊髓。射野内上边界必要时沿胸锁乳突肌走向设铅挡保护喉和脊髓。
⑵ 胸壁切线野:上界与锁骨上野衔接,如单纯胸壁照射上界可达锁骨头下缘,下界为对侧乳腺皮肤皱折下1 cm。内界一般过体中线,外界为腋中线或腋后线,参照对侧腺体附着位置。与保乳术后的全乳照射相同,各边界也需要参考原发肿瘤的部位进行调整,保证原肿瘤部位处于剂量充分的区域,同时需要包括手术瘢痕。胸壁照射如果采用电子线照射,各设野边界可参照高能X线切线野边界。无论采用X线或电子线照射,都需要给予胸壁组织等效填充物以提高皮肤剂量至足量。
⑶ 腋窝照射,非常规根治术后放疗野,如腋下清扫不彻底或存在腋下肿瘤累及/包膜外侵犯等腋下高危复发因素时考虑采用,需注意手术和放疗后腋下臂丛神经损伤及上肢淋巴水肿等长期并发症的可能:①锁骨上和腋窝联合野,照射范围包括锁骨上/下和腋窝,与胸壁野衔接。腋锁联合野的上界和内界都同锁骨上野,下界在第二肋间,外界包括肱骨颈,需保证射野的外下角开放。采用6 MV的X线,锁骨上/下区深度以皮下3~4 cm计算,达到锁骨上区肿瘤量50 Gy(5周,25次)的剂量后,腋窝深度根据实际测量结果计算,欠缺的剂量采用腋后野补量至DT 50 Gy,同时锁骨上区缩野至常规锁骨上野范围,采用电子线追加剂量至50 Gy。②腋后野作为腋锁联合野的补充,采用6 MV的X线,上界平锁骨下缘,内界位于肋缘内1.5 cm,下界同腋窝-锁骨联合野的下界,外界与前野肱骨头铅挡相接,一般包括约1 cm肱骨头。光栏转动以使射野各界符合条件。
⑷ 内乳野:常规定位的内乳野需包括第一至第三肋间,上界与锁骨上野衔接,内界过体中线0.5~1.0 cm,宽度一般为5.0 cm,原则上2/3及以上剂量需采用电子线以减少心脏的照射剂量。
9.5 乳腺癌新辅助治疗、改良根治术后放疗
放疗指征主要综合参考新辅助治疗前的初始分期和新辅助化疗及术后病理学改变的情况,新辅助治疗前初始分期为Ⅲ期及新辅助治疗前后明确淋巴结持续阳性的患者,推荐术后放疗。对于初始腋下淋巴结临床或病理学穿刺活检阳性患者,如腋下淋巴结在新辅助治疗后达到病理学完全缓解(pathological complete response,pCR),目前仍可推荐术后放疗。对于初始分期Ⅰ、Ⅱ期治疗前腋下淋巴结临床及病理学检查评估为阴性,手术治疗后淋巴结阴性的患者目前不推荐术后辅助放疗。放疗技术与未接受新辅助治疗的改良根治术后放疗相同,放疗剂量推荐为常规放疗剂量50 Gy/25次(2 Gy/次),对于影像学(包括功能性影像)上高度怀疑有残留或复发病灶的区域可局部加量至60~66 Gy。
对于有辅助化疗指征的患者,术后放疗推荐在完成辅助化疗后进行;如果无辅助化疗指征,在切口愈合良好,上肢功能恢复的前提下,术后放疗建议在术后8周内尽早开始。与靶向治疗和内分泌治疗的时间配合同保乳治疗或无新辅助化疗的改良根治术后放疗。
9.6 乳房重建术与术后放疗
原则上无论采用哪种手术方式,乳房重建患者的术后放疗指征和靶区都同于非同期重建的乳房切除术后患者。无论是自体组织或假体重建术,都不是放疗的禁忌证。采用自体皮瓣重建术后放疗后的重建失败率小于3%,因此术后放疗可安全地应用于自体皮瓣重建术后的患者。当采用假体重建时,由于放疗以后组织的血供和顺应性下降,总的放疗后假体植入取出率约为10%。采用扩张器-永久性假体二步法重建的患者,扩张器替换成永久性假体可以在术后放疗之前或之后,该时序目前没有绝对定论,取决于整个团队对技术的熟悉程度和经验。
乳房重建以后放疗的技术可以参照保乳术后的全乳放疗,由于重建的乳房后期美容效果在很大程度上取决于照射剂量,而重建后放疗的患者一般都有淋巴引流区的照射指征,所以尽可能提高靶区剂量均匀性,避免照射野衔接处的热点,是减少后期并发症的关键。在这个前提下,推荐采用三维治疗技术,尽可能将淋巴引流区的照射整合到三维治疗计划之中。重建术后的放疗剂量推荐为常规放疗剂量50 Gy/25次(2 Gy/次),对于影像学(包括功能性影像)上高度怀疑有残留或复发病灶的区域可局部加量至60~66 Gy。
10
乳腺癌全身治疗指南
10.1 乳腺癌术后辅助全身治疗临床指南
10.1.1 乳腺癌术后辅助全身治疗的选择
乳腺癌术后辅助全身治疗的选择应基于复发风险的个体化评估、肿瘤病理学的分子分型以及对不同治疗方案预期的反应性。
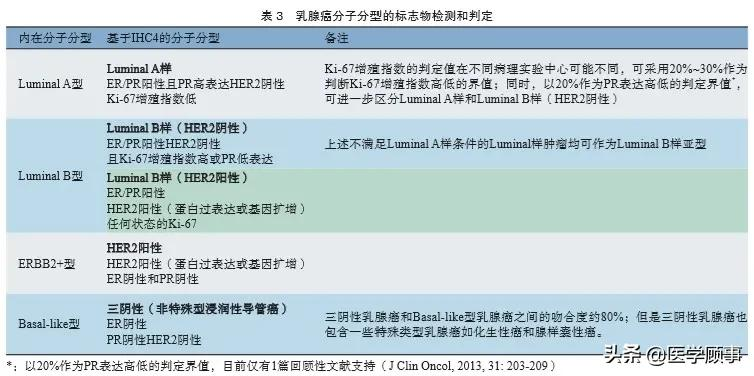
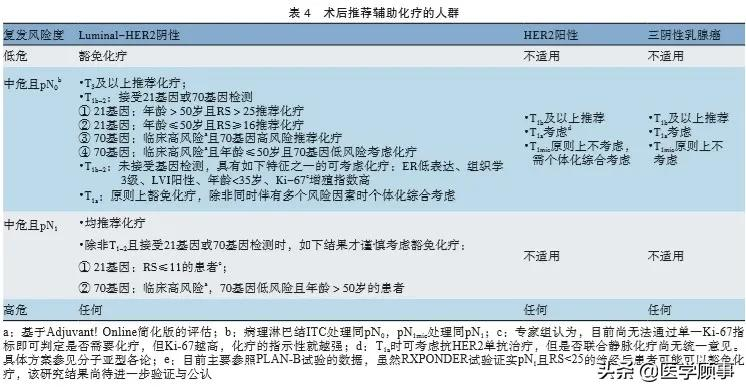
乳腺癌术后复发风险的分组见表2。该表可用于全面评估患者手术以后复发风险的高低,是制定全身辅助治疗方案的重要依据。乳腺癌分子分型的判定见表3。医师应根据患者的分子分型及复发风险选择相应的化疗、内分泌治疗、抗HER2治疗,以及选择是否进行和采纳何种强化治疗。
10.1.2 乳腺癌术后辅助化疗的临床指南
10.1.2.1 乳腺癌术后辅助化疗的人群选择(表4)
多基因检测工具(Oncotype DX®、MammaPrint®等)有助于指导辅助化疗的决策,但推荐使用具备相应资质的检测工具,并期待基于中国人群的检测数据及其预后预测价值分析。对于不具备条件或不愿意接受多基因检测工具检测的患者,辅助化疗与否应综合考虑肿瘤的临床病理学特征、患者生理条件和基础疾患、患者的意愿、化疗的可能获益和不良反应等进行决策。随着二代测序技术的普及和检测费用降低,易感风险基因检测的成本效益将会显著提高,患者年龄将逐渐成为非限制因素。如需要进行易感性咨询与风险评估、并期望针对BRCA致病突变携带者进行多腺苷二磷酸核糖聚合酶[poly(ADPribose)polymerase,PARP]抑制剂靶向治疗时,推荐行BRCA等遗传易感基因检测。

10.1.2.2 乳腺癌术后辅助化疗的禁忌证
⑴ 妊娠期:妊娠早期患者通常禁用化疗,妊娠中期患者应慎重选择化疗。
⑵ 明显衰竭或恶病质。
⑶ 患者拒绝术后辅助化疗。
⑷ 有严重感染、高热、水电解质及酸碱平衡失调的患者。
⑸ 胃肠道梗阻或穿孔者。
⑹ 骨髓储备功能低下,治疗前白细胞≤3.5×109/L,血小板≤75×109/L者。
⑺ 心血管、肝肾功能严重损害者。
10.1.2.3 乳腺癌术后辅助化疗的治疗前谈话
⑴ 辅助化疗的目的是降低肿瘤复发率,提高总生存率。
⑵ 化疗的不良反应。
⑶ 年龄大于70岁的患者接受化疗可能会有获益,但应慎重权衡化疗的利弊。
10.1.2.4 乳腺癌术后辅助化疗的治疗前准备
⑴ 首次化疗前应充分评估患者的脏器功能,检测项目包括血常规、肝肾功能及心电图等。以后每次化疗前均应进行血常规和肝肾功能检查,使用心脏毒性药物前应常规做心电图和(或)左心室射血分数(left ventricular ejection fraction,LVEF)测定,其他检查应根据患者的具体情况和所使用的化疗方案等决定。
⑵ 育龄妇女应确认妊娠试验阴性并嘱避孕。
⑶ 签署抗肿瘤治疗知情同意书。
10.1.2.5 乳腺癌术后辅助化疗的方案(附录Ⅵ)
常用方案有:
①以蒽环类药物为主的方案,如AC(多柔比星/环磷酰胺)、EC(表柔比星/环磷酰胺)。虽然吡柔比星(THP)循证医学资料有限,但在我国日常临床实践中,用THP代替多柔比星也是可行的,THP推荐剂量为40~50 mg/m2。5-氟尿嘧啶在辅助治疗中的价值已逐渐不被认可(GIM-2试验及NSABP B-36试验)。②蒽环类与紫杉类药物联合方案,如TAC(T:多西他赛)。③蒽环类与紫杉类药物序贯方案,如AC→紫杉醇(每周1次),AC→多西他赛(每3周1次),剂量密集型AC继以紫杉醇(每2周1次),剂量密集型AC继以紫杉醇(每周1次)。CALGB 9741研究及EBCTCG meta分析提示,剂量密集型化疗可以给患者带来更多的获益,因此临床实践中,对于三阴性乳腺癌及淋巴结阳性的患者,优先推荐剂量密集型化疗作为辅助治疗方案。④ 不含蒽环类药物的联合化疗方案:TC方案(多西他赛/环磷酰胺4或6个疗程),适用于有一定复发风险、蒽环类药物禁忌或不能耐受的患者;PC方案(每周紫杉醇/卡铂,见PATTERN研究),可考虑在三阴性乳腺癌中使用;CMF方案(环磷酰胺/甲氨蝶呤/5-氟尿嘧啶)目前很少采用。⑤卡培他滨的强化(联合或序贯)可考虑在三阴性乳腺癌中使用,例如CBCSG010研究中蒽环序贯多西紫杉醇同时联合使用卡培他滨,SYSUCC001研究中在辅助静脉化疗后单药卡培他滨1年,以及CREATE-X研究中新辅助化疗non-pCR人群单药卡培他滨8个疗程等。⑥奥拉帕利在致病/疑似致病gBRCA突变高危患者中的强化治疗,OlympiA研究提示在HER2阴性新辅助治疗后nonpCR患者,或直接手术的三阴性乳腺癌[≥pT2和(或)≥pN1]与Luminal型(≥pN2),1年的奥拉帕利可显著改善3年的无侵袭性疾病生存率 (invasive disease-free survival,iDFS)达8.8%,但该药目前尚未获得辅助治疗适应证批准。⑦白蛋白结合型紫杉醇在出于医学上的必要性时(如减少过敏反应等)可尝试替代紫杉醇或多西他赛,但使用时周疗剂量不应超过125 mg/m2。
⑵ HER2阳性乳腺癌常用方案参见:10.1.4 乳腺癌术后辅助抗HER2治疗临床指南中的相应内容。
10.1.2.6 乳腺癌术后辅助化疗的注意事项
⑴ 若无特殊情况,一般不建议减少化疗的周期数。
⑵ 在门诊病历和住院病史中应当记录患者当时的身高、体重及体表面积,并给出药物的每平方米体表面积的剂量强度。一般推荐首次给药剂量应按推荐剂量使用,若有特殊情况需调整时不得低于推荐剂量的85%,后续给药剂量应根据患者的具体情况和初始治疗后的不良反应,可一次性下调20%。每个辅助化疗方案仅允许剂量下调2次。
⑶ 辅助化疗一般不与内分泌治疗或放疗同时进行,化疗结束后再开始内分泌治疗,放疗与内分泌治疗可先后或同时进行。
⑷ 化疗时应注意化疗药物的给药顺序、输注时间和剂量强度,严格按照药品说明和配伍禁忌使用。
⑸ 绝经前患者(包括激素受体阳性或阴性),在辅助化疗期间可考虑使用卵巢功能抑制(ovarian function suppression,OFS)药物保护患者的卵巢功能。推荐化疗前1~2周给药,化疗结束后2周给予最后1剂药物。有妊娠需求的患者,推荐至辅助生殖科咨询。
⑹ 蒽环类药物有心脏毒性,使用时必须评估LVEF,至少每3个月1次。如果患者使用蒽环类药物期间发生有临床症状的心脏毒性,或无症状但LVEF<45%或较基线下降幅度超过15%,可考虑检测心肌肌钙蛋白T(cardiac troponin T,cTnT),必要时应先停药并充分评估患者的心脏功能,后续治疗应慎重。
⑺ 中国专家团认为三阴性乳腺癌的优选化疗方案是含紫杉类药物和蒽环类药物的剂量密度方案。大多数Luminal B(HER2阴性)乳腺癌患者需要接受术后辅助化疗,方案应包含蒽环类和(或)紫杉类药物。
10.1.3 乳腺癌术后辅助内分泌治疗临床指南
10.1.3.1 乳腺癌术后辅助内分泌治疗的人群选择
激素受体ER和(或)PR阳性的乳腺癌患者。皆应接受术后辅助内分泌治疗。依据最新美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)/美国病理学家协会(College of AmericanPathologists,CAP)指南,尽管ER IHC染色为1%~100%的肿瘤皆被视为ER阳性,但ER IHC染色为1%~10%为ER低表达。ER低表达时生物学行为通常与ER阴性乳腺癌相似,在术后辅助内分泌治疗中的获益较少,在做治疗决策时也应当考虑到这一点。
10.1.3.2 乳腺癌术后辅助内分泌治疗前谈话
⑴ 辅助内分泌治疗的目的是降低肿瘤复发率,提高无病生存率和总生存率。
⑵ 内分泌治疗的不良反应。
10.1.3.3 乳腺癌术后辅助内分泌治疗与其他辅助治疗的次序
辅助内分泌治疗与化疗同时进行可能会降低疗效,一般在化疗之后进行,但可以与放疗(他莫昔芬除外)及曲妥珠单抗治疗(±其他抗HER2治疗)同时进行。没有明确证据显示黄体生成素释放激素类似物(luteinizing hormonereleasing hormone analogue,LHRHa)与化疗药物合用会降低疗效,但单独化疗诱导的OFS也许会增加内分泌治疗的效果。
10.1.3.4 乳腺癌术后辅助内分泌治疗的方案
绝经前患者辅助内分泌治疗的方案:
⑴ 辅助内分泌治疗有3种选择:他莫昔芬、OFS加他莫昔芬、OFS加第三代芳香化酶抑制剂。OFS药物推荐用于高复发风险的患者,具体需综合考量年龄、肿块大小、淋巴结状态、组织学分级、Ki-67增殖指数等,亦可采用STEPP评分评估,具体可参见《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)》。对于年轻(<35岁)的乳腺癌患者,更推荐OFS加芳香化酶抑制剂。根据多基因检测的结果,国内外专家也认为有不利因素的亦可考虑加用OFS药物。
⑵ 使用他莫昔芬的患者,治疗期间注意避孕,并每6~12个月行1次妇科检查,通过B超检查了解子宫内膜厚度。服用他莫昔芬5年后,如患者仍处于绝经前状态,部分患者(如高危复发)可考虑延长服用期至10年。目前尚无证据显示,服用他莫昔芬5年后的绝经前患者,后续应用OFS药物联合第三代芳香化酶抑制剂会进一步使患者受益。托瑞米芬在绝经前乳腺癌辅助治疗中的价值尚待大型临床研究的确认,在中国日常临床实践中,托瑞米芬常被用于代替他莫昔芬。
⑶ OFS方式有药物去势、手术切除卵巢、卵巢放射线照射(推荐药物性卵巢去势作为首选)。若采用药物性OFS,目前推荐的治疗时间是5年,但中危患者也可选择使用2~3年。对接受了5年药物性OFS+他莫昔芬/AI治疗的特别高危的绝经前患者,尽管没有较强的循证医学证据,后续也可以考虑延长他莫昔芬单药治疗,或继续维持原方案的延长治疗。绝经前患者在使用GnRHa过程中,无需定期进行雌激素水平检测。药物性卵巢去势,专家团投票认为1月剂型和3月剂型疗效基本相似。
⑷ 高危患者应用他莫昔芬5年后,如处于绝经后状态可继续服用芳香化酶抑制剂5年,未绝经可继续使用他莫昔芬满10年。
⑸ 芳香化酶抑制剂和LHRHa可导致骨密度(bone mineral density,BMD)下降或骨质疏松,因此在使用这些药物前常规推荐BMD检测,以后在药物使用过程中,每12个月监测1次BMD,并进行BMD评分(T-score)。T-score小于-2.5,为骨质疏松,可开始使用双膦酸盐或地舒单抗(denosumab)治疗;T-score为-2.5~-1.0,为骨量减低,给予维生素D和钙片治疗,并考虑使用双膦酸盐;T-score大于-1.0,为骨量正常,不推荐使用双膦酸盐。
⑹ 绝经前患者内分泌治疗过程中,因月经状态改变可能引起治疗调整。
绝经后患者辅助内分泌治疗的方案:
⑴ 第三代芳香化酶抑制剂可以向所有绝经后的ER和(或)PR阳性患者推荐,尤其是具有以下情况的患者:①高复发风险患者;②对他莫昔芬有禁忌的患者或使用他莫昔芬后出现中、重度不良反应的患者;③使用他莫昔芬20 mg/d×5年后的高风险患者。
⑵ 芳香化酶抑制剂可以从一开始就应用5年(来曲唑、阿那曲唑或依西美坦)。不同种类的芳香化酶抑制剂都可选择,药物耐受性和安全性是保障长期内分泌治疗效果的关键。Ⅰ期患者通常建议5年辅助内分泌治疗。对于Ⅱ期淋巴结阴性患者,如初始采用他莫昔芬5年治疗,可推荐芳香化酶抑制剂或他莫昔芬5年;如初始采用5年芳香化酶抑制剂的患者,或采用他莫昔芬治疗2~3年后再转用芳香化酶抑制剂满5年的患者无需常规推荐延长内分泌治疗。对于Ⅱ期淋巴结阳性患者,无论其前5年内分泌治疗策略如何,均推荐后续5年芳香化酶抑制剂的延长治疗。对于Ⅲ期患者,推荐5年芳香化酶抑制剂的延长治疗。延长治疗的患者,其内分泌治疗总时长为8~10年。
⑶ 选用他莫昔芬20 mg/d×5年,是有效而经济的治疗方案。治疗期间应每6~12个月行1次妇科检查,通过B超检查了解子宫内膜厚度。
⑷ 对于≥4个阳性淋巴结的ER阳性乳腺癌患者,无论绝经前或绝经后,均可考虑在标准辅助内分泌治疗基础上增加CDK4/6抑制剂阿贝西利强化2年;1~3个淋巴结阳性且伴有G3/T3/Ki-67≥20%至少一项高危因素的ER阳性患者使用阿贝西利强化也可考虑。
10.1.4 乳腺癌术后辅助抗HER2治疗临床指南
10.1.4.1 乳腺癌术后辅助抗HER2治疗的人群选择
HER2阳性患者的辅助治疗策略可参考表5。HER2阳性是指免疫组织化学法(immunohistochemistry,IHC)检测结果3+,或2+且原位杂交法(in situ hybridization,ISH)检测结果阳性。ISH检测结果判读可参考表6。
10.1.4.2 乳腺癌术后辅助抗HER2治疗的相对禁忌证
⑴ 治疗前LVEF<50%。
⑵ 患者拒绝术后辅助靶向治疗。
10.1.4.3 乳腺癌术后辅助抗HER2治疗前谈话
⑴ 目前多项临床研究结果显示,对于HER2蛋白过表达或有基因扩增(判定为HER2阳性)的乳腺癌患者,采用为期1年的曲妥珠单抗±帕妥珠单抗辅助治疗可以降低乳腺癌的复发率,部分研究显示,特定人群奈拉替尼延长治疗1年或新辅助治疗后未达pCR的患者使用T-DM1强化可进一步降低复发风险。
⑵ HER2状态确认的重要性及其检测费用。


10.1.4.4 乳腺癌术后辅助抗HER2治疗前准备
⑴ 精确的HER2检测。建议将浸润性乳腺癌组织的石蜡包埋标本(蜡块或白片)送往国内有条件的病理科进行复查。
⑵ 心功能检查(心脏超声或核素扫描,以前者应用更为普遍)。
⑶ 签署抗肿瘤治疗知情同意书。
10.1.4.5 乳腺癌术后辅助抗HER2治疗方案
⑴ 曲妥珠单抗用于HER2阳性患者的辅助治疗;淋巴结阴性、0.5 cm<原发浸润灶≤2.0 cm、HER2阳性时,推荐使用曲妥珠单抗,可以考虑每周紫杉醇或TC×4+曲妥珠单抗辅助治疗使用(此处C为环磷酰胺);淋巴结阴性、原发肿瘤<0.5 cm时,可以考虑使用曲妥珠单抗,但证据有限;肿瘤体积小但有淋巴结微转移的患者,可考虑每周紫杉醇或TC×4+曲妥珠单抗辅助治疗。确定HER2阳性小肿瘤是否选择短程化疗联合曲妥珠单抗时,需注意个体化,具体的浸润灶大小、ER状态、患者年龄等都是决策的参考因素。曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)每3周方案,或2 mg/kg(首次剂量4 mg/kg)每周方案。目前推荐的治疗时间仍为1年,可与化疗同时使用或化疗后序贯使用,更推荐同时使用。6个月的短疗程用法仅在PERSEPHONE研究中证实与1年疗程相比具有非劣效性,而2年的疗程未得到更佳的预后获益,故这两种时长均暂不推荐。
⑵ 对于有高危复发风险(如淋巴结阳性)的患者,推荐曲妥珠单抗与帕妥珠单抗双靶向治疗联合辅助化疗(常用的化疗方案为:蒽环类药物序贯紫杉类药物EC-P或紫杉类药物联合卡铂TCb),其中帕妥珠单抗,3周1次,剂量为420 mg(首次剂量为840 mg),共1年;淋巴结阴性的HER2阳性患者,当伴有其他不良预后指标(如Ki-67增殖指数>30%、G3、pT2+等)时,也可推荐HP辅助双靶治疗;具有中高复发风险的患者,特别是ER阳性,亦可考虑在曲妥珠单抗治疗结束后,给予1年的酪氨酸激酶抑制剂如奈拉替尼强化治疗。
⑶ 对新辅助治疗未达到pCR的HER2阳性患者,可使用T-DM1(每3周1次,共14次)替代曲妥珠单抗。虽然证据有限,当T-DM1未可及时,可以考虑加用酪氨酸激酶抑制剂(如奈拉替尼)辅助强化治疗。
⑷ 担心心脏毒性者可选择心脏毒性相对较低的去蒽环类药物方案:TCbH、TC4H(此处C为环磷酰胺)和wPH治疗方案(见APT研究:紫杉醇周疗加曲妥珠单抗方案)。
⑸ 曲妥珠单抗生物类似药,可按照国内获批的说明书上适应证使用。
10.1.4.6 乳腺癌术后辅助抗HER2治疗的注意事项
⑴ 首次治疗后观察4~8 h。
⑵ 与蒽环类药物同期应用必须慎重,但可以在前、后阶段序贯应用。与非蒽环类药物化疗、内分泌治疗或放疗都可同期应用。
⑶ 每3个月监测1次LVEF。治疗中若出现LVEF<50%或低于治疗前16%以上,应暂停治疗,并跟踪监测LVEF动态变化,直至恢复到50%以上方可继续用药。若不恢复,或继续恶化或出现心力衰竭症状则应当终止曲妥珠单抗治疗。
10.2 乳腺癌新辅助治疗临床指南
10.2.1 乳腺癌新辅助治疗的人群选择
新辅助治疗的定义为未发现远处转移的乳腺癌患者,在计划中的手术治疗或手术加放疗的局部治疗前,以全身系统性治疗作为乳腺癌的第一步治疗。乳腺癌的新辅助治疗包括新辅助化疗、新辅助靶向治疗及新辅助内分泌治疗。在当前临床实践过程中,乳腺癌新辅助治疗的目的应该从实际的临床需求出发,以治疗的目的为导向,主要包括将不可手术乳腺癌降期为可手术乳腺癌,将不可保乳的乳腺癌降期为可保乳的乳腺癌,以及获得体内药敏反应的相关信息,从而指导后续治疗以期改善患者预后,而并非所有需要行辅助化疗的乳腺癌患者都适合推荐行新辅助化疗。
新辅助治疗适用人群:专家组认为对于新辅助治疗的适用人群,根据新辅助治疗的目的可分为必选人群和优选人群。其中必选对象是以临床降期为目的,降期后手术的患者(如局部晚期不可手术、主观上强烈要求的降期保乳和降期保腋窝);优选对象是能获得体内药敏信息,从而指导后续治疗的患者(如具有一定肿瘤负荷的HER2阳性/三阴性乳腺癌,新辅助治疗non-pCR后可予以辅助强化治疗)。基于目前循证医学的证据,相同方案和疗程的新辅助治疗的效果与辅助治疗的效果是一样的,且可以使部分不能保乳的患者获得保乳的机会,部分不可手术的患者获得手术的机会;新辅助治疗后未达pCR的患者有机会使用强化治疗方案进一步降低复发和死亡风险;但是一部分患者(小于5%)在新辅助治疗的过程中可能出现进展,甚至丧失接受手术治疗的机会。并非所有需要行辅助治疗的乳腺癌患者都适合推荐行新辅助治疗,也不适合将三阴性和HER2阳性型作为优选新辅助治疗的唯一依据,这两种分子分型当同时伴有较高肿瘤负荷时(如cT2及以上或cN1及以上)可考虑优选新辅助治疗。新辅助治疗有时亦可使不可保腋窝的乳腺癌有机会降期为可保腋窝,中国专家对此持审慎观点,认为实际操作过程中存在SLN评估假阴性率高、长期安全性数据不足等风险,并不常规推荐将已证实转移的区域淋巴结进行降期保腋窝作为新辅助治疗的目的。
对不可手术的隐匿性乳腺癌行新辅助治疗是可行的(其中隐匿性乳腺癌定义为腋窝淋巴结转移为首发症状,而乳房内未能找到原发灶的乳腺癌)。对于需要延迟手术的患者(如制订手术计划需要等待基因检测结果,以便有时间考虑重建方案)或不可避免地需要延迟手术的患者[2019冠状病毒(COVID-19)疫情],可以先行新辅助治疗。
10.2.2 乳腺癌新辅助治疗的禁忌证
⑴ 未经组织病理学确诊的乳腺癌。推荐进行组织病理学诊断,并检测ER、PR、HER2及Ki-67等免疫组织化学指标,不推荐将细胞学检查作为病理学诊断标准。
⑵ 妊娠早期女性为绝对禁忌。而妊娠中后期女性患者应慎重选择新辅助治疗,为相对禁忌,这方面国外有成功应用的个案报道。
⑶ 心血管、肝肾功能显著损害者。
⑷ 原位癌成分太多造成无法确认浸润性癌的大小或无法临床评估疗效者需谨慎使用。
⑸ 肿瘤的范围难以界定者。
⑹ 患者拒绝术前新辅助治疗。
⑺ 有严重感染、高热、水电解质及酸碱平衡紊乱的患者。
⑻ 骨髓储备不足,治疗前中性粒细胞≤1.5×109/L,血小板≤75×109/L者。
10.2.3 乳腺癌新辅助治疗前谈话
⑴ 为什么要做新辅助治疗:①新辅助治疗是局部晚期乳腺癌或炎性乳腺癌的规范疗法,可以使肿瘤降期以利于手术,或变不能手术为能手术;②对于肿瘤较大且有保乳意愿的患者,新辅助治疗可以提高保乳率,需要严格掌握保乳适应证、遵照保乳手术规范综合治疗;③不可保腋窝的乳腺癌有机会降期为可保腋窝,中国专家对此持审慎观点,认为实际操作过程中存在SLN评估假阴性率高、长期安全性数据不足等风险,并不常规推荐将已证实转移的区域淋巴结进行降期保腋窝作为新辅助治疗的目的。④获得体内药物敏感性的相关信息,若新辅助治疗能达到pCR,则预示较好的远期效果(pCR和长期预后相关性较强的是三阴性和HER2阳性型乳腺癌);如未能达到pCR,可以指导后续强化治疗方案以期改善患者预后。
⑵ 新辅助治疗存在一定的疾病进展概率,推荐患者每个周期行临床查体评估,每2个疗程要进行1次影像学评估,以监测治疗反应。部分乳腺癌对新辅助治疗初始治疗方案不敏感:若2个周期化疗后肿瘤无变化或反而增大时,应根据实际情况考虑是否需要更换化疗方案或采用其他疗法。目前无充分证据表明血液和组织的生物学标志物可用于监测新辅助治疗的效果。
⑶ 接受有效的新辅助治疗之后,即便临床上肿瘤完全消失,也必须接受既定的后续治疗,包括手术治疗,并根据手术前后病理学检查结果决定进一步辅助治疗的方案。
10.2.4 乳腺癌新辅助治疗的实施
10.2.4.1 治疗前准备
⑴ 病灶基线体检。精确测量乳腺所有原发灶最长径和腋窝淋巴结的短径。
⑵ 基线影像学评估。超声和乳腺X线检查是不可或缺的,乳腺MRI准确率可达84%,对于需降期保乳的患者,应常规进行乳腺MRI检查。
⑶ 血常规、肝肾功能、心电图、胸部CT(平扫或增强)及肝脏超声检查。局部晚期乳腺癌或炎性乳腺癌患者建议加做全身骨扫描、胸部CT。脑评估或PET/CT尽管具有一定的提示意义,但由于影像学评价指标不统一和临床可及性欠佳,并非接受新辅助治疗患者的常规推荐检查项目。基线心功能检查(如心超测LVEF)是推荐的。
⑷ 治疗前必须对乳腺原发灶行空芯针活检(或真空辅助活检),诊断为浸润性癌或原位癌(可能存在组织学低估)同时伴有细针(或空芯针)穿刺证实的同侧腋窝淋巴结转移,明确组织学诊断及免疫组织化学检查(隐匿性乳腺癌除外)。
⑸ 肿大的区域淋巴结是否为乳腺癌转移,应通过细针(或空芯针)穿刺获得病理学证实。
⑹ 育龄妇女应确认妊娠试验阴性并嘱避孕。
⑺ 告知抗肿瘤治疗的不良反应,签署抗肿瘤治疗知情同意书。
⑻ 对患者原发灶的范围采用超声引导下放置金属标记物或表皮纹身的方式进行标识,为确定手术范围提供信息。
⑼ 可在新辅助治疗前对临床淋巴结阴性的患者进行腋窝SLNB,可以为后续的手术和全身治疗提供更多的参考。当前专家组推荐对于临床淋巴结阴性拟行新辅助治疗的患者,倾向在新辅助治疗后行SLNB手术,特别是三阴性及HER2阳性患者。
10.2.4.2 乳腺癌新辅助治疗的方案(附录Ⅵ)
应当依据患者乳腺癌分子分型、药物的可获得性、患者的个体情况进行新辅助治疗方案的设计。新辅助治疗方案包括:化疗联合或不联合靶向治疗(如HER2阳性联合抗HER2治疗、三阴性联合免疫治疗)、内分泌治疗联合或不联合靶向治疗(如HR阳性/HER2阳性可两者联合使用)、单纯抗HER2治疗(如HR阴性/HER2阳性)。
⑴ 对于HR阳性/HER2阴性的乳腺癌患者,有降期或保乳等需求的,如无需术后病理学检查结果和(或)肿瘤特异性基因检测结果就可以判断需要术后辅助化疗,优先推荐辅助化疗提前到新辅助阶段。新辅助内分泌治疗与新辅助化疗具有相似的临床缓解率,现有证据不支持新辅助内分泌治疗时常规联合CDK4/6抑制剂。特别需要指出的是,这类乳腺癌达到pCR的很罕见。绝经后患者通常使用AI进行新辅助内分泌治疗;绝经前患者除非进入临床研究或有化疗禁忌(可选OFS+AI/氟维司群),不应常规进行新辅助内分泌治疗。新辅助内分泌治疗的最佳持续时间尚不清楚,应该通过仔细评估患者的临床状态和随着时间推移的临床反应来确定个体化的给药时间,一般应持续3~6个月或至最佳疗效。
⑵ 对于拟行新辅助治疗的HER2阳性乳腺癌患者,应采用曲妥珠单抗联合帕妥珠单抗进行新辅助治疗,优选的化疗配伍为紫杉类药物联合卡铂(TCbHP、PCbHP),而蒽环类药物序贯紫杉类药物也是一种可选的方案(ECHP-THP)。不能耐受或不愿接受化疗的患者,HR阳性/HER2阳性可考虑内分泌治疗联合抗HER2治疗,HR阴性/HER2阳性可考虑单纯抗HER2治疗。
⑶ 对于拟行新辅助治疗的三阴性乳腺癌患者,推荐含蒽环类药物和紫杉类药物的常规方案(EC-T、EC-P)。铂类药物可作为三阴性乳腺癌患者新辅助治疗方案的一部分(TCb、PCb或EC-TCb、EC-PCb),以增加肿瘤退缩的概率和pCR的可能性,但决策加铂类药物应该权衡潜在的获益与伤害,因为未必能转化为DFS的远期获益。单纯BRCA1/2致病或疑似致病性突变,不足以成为选择含铂类药物治疗的理由。对于有心脏基础疾患的患者,可以考虑单纯紫杉类+铂类药物的新辅助治疗。虽然Keynote522和IMpassion031研究提示,早期三阴性乳腺癌新辅助治疗添加PD-1/PD-L1抗体治疗可改善pCR,但因远期毒性和获益未明,且PD-1/PD-L1抗体在国内尚未获批相关适应证,不常规推荐在此类患者新辅助治疗中添加免疫检查点抑制剂。
10.2.4.3 乳腺癌新辅助治疗的注意事项:
⑴ 在门诊病历和住院病史中需记录患者当时的身高、体重及体表面积,并给出药物给药剂量强度。一般推荐首次给药剂量不得低于推荐剂量的85%,后续给药剂量应根据患者的具体情况和初始治疗后的不良反应,可以1次下调20%~25%,每个新辅助化疗方案仅允许剂量下调2次。
⑵ 在治疗有反应或疾病稳定的患者中,推荐手术前用完所有的既定周期数。
10.2.4.4 乳腺癌新辅助治疗的疗效评估和方案调整
⑴ 建议在治疗第1个周期的最后1天,亦即计划第2个周期治疗之前,进行细致的临床体检,初步了解治疗后的反应,如果肿瘤明确增大,要考虑早期进展的可能。
⑵ 一般情况下,建议在治疗第2个周期末,即计划第3个周期之前全面评估疗效。新辅助治疗前后的检查手段应该一致,评价结果按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumor,RECIST)1.1标准分为完全缓解(complete response,CR)、部分缓解(partial response)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。
⑶ 可根据新辅助治疗中疗效评估结果决定后续新辅助治疗方案执行既定计划还是进行方案调整。新辅助治疗期间应重视早期疗效的评估和判断(2~4个疗程),当判断为较显著增大的SD或PD时,建议分为两种情况,一种为不可手术的,建议立即经验性更换新辅助治疗方案并密切评估;一种为可手术的,可以考虑尽早手术(特别是Luminal型,或采用了标准方案4疗程后疗效不佳的三阴性和HER2阳性患者,专家组建议尽早完成根治性手术)。部分专家也认同可以经验性更换新辅助治疗方案并密切评估,后者仍然具有体内药敏测试的价值。
⑷ 对CR或部分缓解或未显著增大的SD的患者,目前推荐完成既定的新辅助治疗疗程,即便肿瘤退缩明显,也应完成原计划疗程(除非不能耐受),避免因治疗有效而临时中断新辅助治疗、立即手术的情况。推荐新辅助化疗±靶向治疗总疗程数为6~8个周期,完成的患者可不再进行术后辅助化疗,部分未达pCR的患者可考虑强化治疗。
⑸ 根据新辅助治疗结束后的疗效评估结果决定随后的辅助治疗方案,对未达到pCR的患者,尤其是三阴性及HER2阳性患者,可采用辅助强化治疗。
10.2.5 乳腺癌经新辅助治疗降期后的局部和全身处理
10.2.5.1 局部处理
⑴ 乳房手术:手术可根据个体情况选择保留乳房或全乳切除。
⑵ 腋窝淋巴结手术:新辅助治疗前的SLN为阴性,新辅助治疗后可免去腋窝淋巴结评估。新辅助治疗前,腋窝淋巴结穿刺活检证实为转移或SLN有转移的,大多数中国专家建议即使降期仍需谨慎行SLNB以替代腋窝清扫。新辅助治疗后腋窝SLNB若有宏转移或微转移,以及新辅助治疗前T4或N2/3的患者一般都推荐行腋窝清扫,详见《乳腺癌前哨淋巴结活检临床指南》。
⑶ 术后辅助放疗:推荐根据化疗前的肿瘤临床分期来决定是否需要辅助放疗及放疗范围。放疗范围包括全胸壁和锁骨上和锁骨下范围,临床上内乳淋巴结有累及或临床上高度怀疑内乳淋巴结可能会累及的病例需添加内乳区放疗。
10.2.5.2 全身处理
⑴ 新辅助治疗结束后的疗效评估结果决定随后的辅助治疗方案,对未达到pCR的患者(已完成足疗程的新辅助治疗),尤其是三阴性乳腺癌患者,可考虑术后追加6~8个疗程卡培他滨治疗(采用单药铂类或其他静脉化疗的强化方案目前证据不足);HER2阳性患者,优先考虑采用T-DM1(每3周1次,共14次)强化辅助治疗的方式,T-DM1不可及时可采用含TKI方案予以辅助强化,部分专家认为可依据之前新辅助治疗的反应性(如术后MP分级等)以及患者情况(治疗费用和不良反应)协助判断选用何种方式更佳,但目前前者的循证医学证据仍不够充分,在退缩较好(譬如退缩>90%以上,MP=4时)也可采用继续完成曲妥珠单抗联合帕妥珠单抗共1年的方式。无论是否达到pCR,ExteNET试验显示,特定人群奈拉替尼延长治疗1年可进一步降低复发风险。对于HR阳性的患者,需要给予内分泌治疗,内分泌治疗是否需要强化,以及强化的方式可主要依据患者新辅助治疗前的状态进行评估,并参考10.1.3进行。
10.3 晚期乳腺癌解救性全身治疗临床指南
晚期乳腺癌包括复发和转移性乳腺癌,是不可治愈的疾病。治疗的主要目的是缓解症状、提高生活质量和延长患者生存期。应尽可能在决定治疗方案前对复发或转移部位进行活检,尤其是孤立性病灶,以明确诊断和重新评估肿瘤的ER、PR和HER2状态。局部治疗,如手术和放疗在初治为Ⅳ期乳腺癌中的价值还不明确。只有当全身药物治疗取得较好的疗效时,才可考虑姑息性的局部治疗,以巩固全身治疗的效果。局部及区域复发而没有远处转移的患者,对于经过全面评估后认为适合根治性局部治疗的局部区域复发的乳腺癌,应当给予根治性治疗。例如,保乳术后复发的患者可行全乳切除,胸壁或区域淋巴结复发的可行受累部位及淋巴结切除,之前未经放疗的可加用局部放疗,再次辅助化疗(主要为激素受体阴性患者)、靶向治疗和内分泌治疗具有一定的价值。复发或转移性乳腺癌常用的化疗和靶向治疗方案见附录Ⅶ。
10.3.1 晚期乳腺癌内分泌治疗临床指南
10.3.1.1 晚期乳腺癌内分泌治疗的人群选择
⑴ ER和(或)PR阳性的复发或转移性乳腺癌。受体状态不明的患者,如临床病程发展缓慢,也可以试用内分泌治疗。
⑵ 非内脏危象的患者。内脏危象定义为:由症状、体征、实验室检查及疾病快速进展确认的数个脏器功能异常。内脏危象并非单纯指存在内脏转移,而指危重的内脏情况需快速、有效地治疗以控制疾病进展,尤其指进展后就失去化疗机 会的情况。无症状的内脏转移和(或)骨软组织转移更推荐内分泌治疗。
⑶ 复发距开始辅助内分泌治疗的时间较长(一般大于2年,联合部分靶向药物时可适当突破该界限)。
10.3.1.2 晚期乳腺癌内分泌治疗前谈话
⑴ 复发或Ⅳ期乳腺癌的全身治疗主要以延长无进展生存期(progression-free survival,PFS) 及总生存期(overall survival,OS)、提高生活质量为目的,而非治愈。因此,应优先选择毒性较小的治疗方案。已有数据显示,内分泌联合靶向治疗的疾病控制率和PFS并不劣于甚至优于化疗。内分泌治疗有多种选择,可以依次进行,尽量延长患者进入化疗的时间。
⑵ 内分泌治疗不良反应的患者宣教。
10.3.1.3 晚期乳腺癌内分泌治疗的相关概念
⑴ 原发性内分泌治疗耐药:指早期乳腺癌术后辅助内分泌治疗2年内出现疾病复发转移,或转移性乳腺癌内分泌治疗6个月内出现疾病进展。
⑵ 继发性内分泌治疗耐药:指早期乳腺癌术后辅助内分泌治疗2年后至治疗结束后1年内出现疾病复发转移,或转移性乳腺癌内分泌治疗6个月或以上出现疾病进展。
⑶ 内分泌治疗敏感:指初治Ⅳ期未经内分泌治疗,或早期乳腺癌术后辅助内分泌(至少2年)治疗结束后1年以上出现疾病复发转移。
⑷ 内分泌一线治疗和二线治疗:通常分别对应复发转移后接受的第一个和第二个内分泌治疗方案;但考虑到定义要为后续治疗决策服务,推荐将内分泌一线治疗定义为内分泌治疗敏感的复发转移患者后续进行的第一个内分泌治疗方案,而将已判断为原发性或继发性内分泌治疗耐药的复发转移患者后续接受的内分泌治疗解救方案定义为二线治疗。
10.3.1.4 晚期乳腺癌内分泌治疗的药物(绝经定义参见附录Ⅷ)
⑴ 绝经后患者的内分泌治疗推荐:芳香化酶抑制剂包括非甾体类(阿那曲唑和来曲唑)、甾体类(依西美坦)、ER调变剂(他莫昔芬和托瑞米芬)、ER下调剂(氟维司群)、孕酮类药物(甲地孕酮和甲羟孕酮)、雄激素(氟甲睾酮)及大剂量雌激素(乙炔基雌二醇)。
⑵ 绝经前患者的内分泌治疗推荐:在OFS基础上(主要是使用LHRHa和手术去势),可参照绝经后乳腺癌处理。未行OFS的,可考虑ER调变剂(他莫昔芬和托瑞米芬)、孕酮类药物(甲地孕酮和甲羟孕酮)、雄激素(氟甲睾酮)及大剂量雌激素(乙炔基雌二醇)。
⑶ 绝经前和绝经后患者均可考虑在内分泌治疗的基础上联合靶向治疗(CDK4/6抑制剂、mTOR抑制剂、HDAC抑制剂等,PI3Kα抑制剂尚未在国内上市)。
10.3.1.5 晚期乳腺癌一线内分泌治疗的选择和注意事项
⑴ 芳香化酶抑制剂联合CDK4/6抑制剂(帕柏西利、阿贝西利和瑞波西利)是HR阳性/HER2阴性绝经后(自然绝经或手术去势)或绝经前但经药物去势后乳腺癌患者一线内分泌治疗的优先选择,多项研究已证实联合CDK4/6抑制剂可显著改善患者的PFS,甚至部分研究可改善OS。
⑵ 氟维司群(±OFS)联合CDK4/6抑制剂并非优选,在PARSIFAL研究中未能证实比 芳香化酶抑制剂(±OFS)联合CDK4/6的抑制剂更优。他莫昔芬+OFS联合CDK4/6抑制剂在MONALEESA-7试验中也证实了PFS和OS的获益,特定情况下亦可选用。
⑶ 当CDK4/6抑制剂不可及时,单药内分泌治疗也是可行的;绝经后(自然绝经或手术去势)患者可使用氟维司群、AI、ER调变剂(他莫昔芬和托瑞米芬);绝经前患者可使用OFS联合氟维司群、OFS联合AI、OFS联合ER调变剂、单纯ER调变剂。
⑷ 绝经前患者在使用OFS药物后,可按照绝经后模式处理。
10.3.1.6 晚期乳腺癌二线内分泌治疗的选择和注意事项
一线内分泌治疗失败后,非内脏危象的患者仍然可以选择二线内分泌治疗±靶向治疗。不推荐重复使用辅助治疗或一线治疗已被证明耐药的内分泌治疗药物。绝经前患者在使用OFS药物后,可按照绝经后模式处理。
⑴ 对于尚未使用过CDK4/6抑制剂的患者:
①氟维司群联合CDK4/6抑制剂(帕柏西利、阿贝西利和瑞波西利)是HR阳性/HER2阴性绝经后(自然绝经或手术去势)或绝经前但经药物去势后乳腺癌患者二线内分泌治疗的优先选择,多项研究已证实,联合CDK4/6抑制剂可显著改善患者的PFS和OS。对于原发性内分泌治疗耐药的患者,氟维司群联合特定的CDK4/6抑制剂阿贝西利获益证据相对充分。②甾体/非甾体芳香化酶抑制剂(±OFS)或他莫昔芬(±OFS)联合CDK4/6抑制剂在特定情况下亦可选用。对于已经使用过CDK4/6抑制剂的患者,目前并无充分证据支持CDK4/6抑制剂的跨线治疗。
⑵ mTOR抑制剂依维莫司、HDAC抑制剂西达本胺可考虑在二线治疗中联合内分泌治疗使用。PI3Kα抑制剂Alpelisib在PI3Kα突变(经肿瘤组织或外周血ctDNA检测)的患者中联合内分泌治疗的效果有一定证据,已在美国和欧盟取得适应证,国内尚未获批。
⑶ 原发性内分泌治疗耐药患者,如以上联合的小分子靶向药物不可及时,可采用化疗予以解救治疗。
10.3.2 晚期乳腺癌化疗±靶向治疗的临床指南
10.3.2.1 晚期乳腺癌化疗±靶向治疗的人群选择
属于以下1种情况即可考虑化疗±靶向治疗:
⑴ 激素受体阴性或低表达。
⑵ 内脏危象或有症状的内脏转移。
⑶ 激素受体阳性但已证实对内分泌治疗耐药 (特别是原发性耐药)。
10.3.2.2 晚期乳腺癌化疗±靶向治疗前谈话
⑴ 化疗±靶向治疗的目的是改善生活质量,延长PFS及OS。
⑵ 化疗±靶向治疗不良反应的患者宣教。
10.3.2.3 晚期乳腺癌化疗±靶向治疗前准备
⑴ 首次化疗前应进行血常规、肝肾功能及心电图检查。以后每次化疗前均应进行血常规检查,肝肾功能异常者需持续监测。使用蒽环类药物者还需进行心电图和LVEF检查,异常者需持续监测。
⑵ 育龄妇女应确认妊娠试验阴性并嘱避孕。
⑶ 签署抗肿瘤治疗知情同意书。
10.3.2.4 HER2阴性晚期乳腺癌化疗±靶向治疗的选择和注意事项(附录Ⅶ)
⑴ 推荐的首选化疗方案包括单药序贯化疗或联合化疗,其中序贯使用单药为优选,可保障治疗耐受性和生活质量。与单药化疗相比,联合化疗通常有更好的缓解率和PFS,然而联合化疗的毒性较大且未能证实总生存获益。需要使肿瘤迅速缩小或症状迅速缓解的患者可选择联合化疗。
⑵ 蒽环类(紫杉类)药物治疗失败的常用定义为使用蒽环类(紫杉类)药物解救化疗过程中疾病进展,或辅助治疗结束后12个月内发生复发转移。对于既往蒽环类药物治疗失败的患者,通常首选以紫杉类药物(如紫杉醇、多西他赛及白蛋白结合型紫杉醇)为基础的单药或联合方案;对于既往蒽环类药物和紫杉类药物治疗均失败的患者,目前尚无标准化疗方案,可考虑其他单药或联合方案。
⑶ 常用单药包括:蒽环类药物,如多柔比星、表柔比星、吡柔比星及聚乙二醇化脂质体多柔比星;紫杉类药物,如紫杉醇、多西他赛及白蛋白结合型紫杉醇;抗代谢类药物,如卡培他滨和吉西他滨;非紫杉类微管类抑制剂,如长春瑞滨、艾立布林、优替德隆(UTD1);铂类药物,如顺铂和卡铂;DNA拓扑异构酶抑制剂依托泊苷等。
⑷ 联合化疗方案:联合化疗方案多种多样,主要基于既往循证医学的证据、联合药物之间的相互作用、联合药物的毒性谱、患者的个体状态来综合制定,不推荐联合3种或3种以上的化疗药物。对于三阴性乳腺癌,可选择GP方案(吉西他滨联合顺铂,尤其是携带BRCA1/2等同源重组修复基因缺陷的患者)、GC方案(吉西他滨联合卡铂)、AP方案(白蛋白结合型紫杉醇联合顺铂/卡铂)、PC方案(其他紫杉类药物联合卡铂/顺铂)。
⑸ 单药或联合化疗均可在循证医学证据支持下联合靶向治疗。如依据IMpassion130和Keynote355研究,可尝试白蛋白结合型紫杉醇+阿替利珠单抗(PD-L1 IHC阳性时)、白蛋白结合型紫杉醇/紫杉醇/GC+帕博利珠单抗(PD-L1 CPS≥10时),但因PD-1/L1抗体治疗尚未获得相应适应证,临床实践中应慎重选择患者。化疗联合抗血管生成药物贝伐珠单抗可在疾病缓解及PFS方面得到获益,但OS未见延长,不推荐常规使用,但可在急需肿瘤或症状控制的患者中谨慎选择。
⑹ 联合化疗时,是采用持续方式还是4~8个疗程后停药或维持治疗需权衡疗效、药物不良反应和患者生活质量。联合化疗有效但不能耐受或无意愿继续联合化疗者可考虑维持治疗,可选择原先联合方案中的一个单药化疗维持(如口服卡培他滨、长春瑞滨),激素受体阳性者还可考虑内分泌治疗±靶向治疗维持。
⑺ BRCA1/2胚系致病性或疑似致病性突变的患者,可以选择PARP抑制剂(奥拉帕利/talazoparib,其中奥拉帕利已在国内上市,但尚未获批相应适应证)进行治疗,或考虑参加相应临床试验。
⑻ 对于三阴性乳腺癌,以TROP2为靶点、与DNA拓扑异构酶Ⅰ抑制剂偶联的戈沙妥珠单抗(sacituzumab govitecan-hziy)是一种新的治疗选择,此药已获得美国食品药品管理局(Food and Drug Administration,FDA)批准,正在中国开展临床研究。
10.3.3 HER2阳性晚期乳腺癌治疗临床指南
10.3.3.1 晚期乳腺癌抗HER2治疗的人群选择
HER2阳性的复发或转移性乳腺癌。HER2的规范化检测和阳性的判定应参照ASCO/CAP指南或中国相关的指南。HER2阳性是指免疫组织化学法检测结果3+,或2+且原位杂交法检测结果阳性。原发灶和转移灶之间、多次转移灶之间如HER2检测结果不一致的,以最近1次的转移灶检测为准,同时考虑到HER2状态的时空异质性问题,不完全排斥在即使最近1次转移灶检测HER2转阴的情况下,继续谨慎选择抗HER2治疗并持续监测疗效。
10.3.3.2 抗HER2单抗使用的注意事项
⑴ 曲妥珠单抗、帕妥珠单抗:治疗前LVEF<50%。应用前应进行心功能基线评估,对 于心血管事件高危人群应尽量避免使用。
⑵ 同时进行蒽环类药物化疗。应尽量避免同时使用蒽环类等也具有心血管毒性的药物。
⑶ 治疗过程中应定期进行心功能评估,若LVEF较基线下降≥15%或低于正常范围且下降≥10%,应暂停抗HER2治疗,于3~4周内复查LVEF,再次评估是否能继续抗HER2治疗。
⑷ T-DM1:基线及用药期间应行血小板规范监测,若出现血小板减少应及时减量或停药。出现2级及以上血小板减少时应警惕发展为持续性血小板减少症的可能,若常规升血小板治疗效果不佳,应及时请专科医师会诊并处理。
10.3.3.3 晚期乳腺癌抗HER2治疗前谈话
⑴ 充分告知HER2阳性乳腺癌患者及时进行抗HER2治疗的获益。抗HER2治疗的国内外常用药物包括:曲妥珠单抗及其生物类似物、帕妥珠单抗、伊尼妥单抗、Margetuximab、拉帕替尼、吡咯替尼、奈拉替尼、图卡替尼、T-DM1、DS8201等。
⑵ 单抗类药物曲妥珠单抗及其生物类似物、帕妥珠单抗、伊尼妥单抗等的总体安全性良好,但有可能影响心脏射血功能和增加充血性心力衰竭的概率;使用TKI类药物(拉帕替尼、吡咯替尼、奈拉替尼、图卡替尼)有腹泻等消化道反应;使用T-DM1有发生血小板减少症的风险;使用DS8201有发生间质性肺病的风险。使用以上药物时需遵医嘱配合定期随访监测(如使用单抗类药物时每3个月复查一次LVEF)。
10.3.3.4 晚期乳腺癌抗HER2治疗前准备
⑴ 准确的HER2检测。必要时将蜡块或白片送往国内广泛认可的医院病理科进行复核。有条件时尽量行转移灶的再次活检,以明确转移灶的HER2状态 。
⑵ 心功能检查(心脏超声或核素扫描,前者应用更普遍)。
⑶ 签署抗肿瘤治疗知情同意书。
10.3.3.5 晚期乳腺癌抗HER2治疗的选择和注意事项(详见14.2章节内容)
持续的抗HER2治疗是HER2阳性晚期乳腺癌重要的治疗原则。
⑴ 对于未使用过曲妥珠单抗或符合曲妥珠单抗再使用条件(曲妥珠单抗辅助治疗结束后超过1年以上复发转移的)的患者,应首选以曲妥珠单抗±帕妥珠单抗为基础的一线治疗,优选联合紫杉类药物。紫杉类药物联合曲妥珠单抗、帕妥珠单抗双靶一线治疗较紫杉类药物联合曲妥珠单抗可延长PFS和OS。伊尼妥单抗联合长春瑞滨等化疗也可作为曲妥珠单抗非耐药患者的抗HER2治疗选择之一。
⑵ 对于曲妥珠单抗±帕妥珠单抗治疗失败患者,单药T-DM1可延长PFS和OS;吡咯替尼(或奈拉替尼)联合卡培他滨较拉帕替尼联合卡培他滨单药可延长PFS。单纯两种靶向药物的联合(如拉帕替尼联合曲妥珠单抗)也有证据表明可改善OS。专家组推荐,对于帕妥珠单抗+曲妥珠单抗辅助治疗结束1年后复发转移的乳腺癌患者,可选的一线解救治疗策略包括:吡咯替尼+卡培他滨、T-DM1、或帕妥珠单抗+曲妥珠单抗+多西紫杉醇等。Margetuximab、图卡替尼和DS8201在多线治疗后的临床研究中有一定效果,但国内尚未上市,需谨慎选择。
⑶ 曲妥珠单抗允许进行跨线治疗。
⑷ 对于HR阳性/HER2阳性的患者,不能耐受/拒绝化疗或化疗后维持治疗时,可以选用内分泌治疗+抗HER2(单靶或双靶)治疗,但无明确证据显示能改善OS。
⑸ 生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。曲妥珠单抗生物类似药国内已获批,可适当外推用于HER2阳性乳腺癌相关的适应证。
⑹ 对于脑转移的患者,TKI类药物和ADC药物可优先选择。
⑺ 多线抗HER2治疗失败,无标准治疗或无法获得进一步治疗药物的,建议参加临床试验。
10.4 终末期乳腺癌姑息治疗临床指南
姑息治疗是一门临床学科,通过早期识别、积极评估、控制疼痛和治疗其他疾病相关症状,包括躯体、社会心理和心灵的困扰来预防和缓解身心痛苦,改善因疾病而威胁生命的患者及其家属的生活质量。
10.4.1 适应人群
⑴ 有未控制的肿瘤相关症状,如疼痛、呼吸困难、厌食和恶病质、恶心和呕吐等。
⑵ 有与肿瘤诊断和治疗相关的中、重度生理和心理问题。
⑶ 有严重的伴发疾病、精神和社会心理状况。
⑷ 预期生存时间少于或等于6个月。
⑸ 患者及家属有了解疾病发展过程和参与治疗决定的需求。
⑹ 患者及家属有姑息治疗的需求。
10.4.2 终末期乳腺癌患者姑息治疗前谈话
⑴ 与患者及家属沟通,使他们了解该疾病发展的自然病程和预后,抗肿瘤治疗的意义和可能带来的不良反应及并发症,理解后续治疗的性质和方法。
⑵ 了解患者及家属对姑息治疗的预期和要求,作出相应的治疗决定并制定具体措施。
⑶ 治疗过程中反复与患者及家属沟通,及时了解他们的治疗预期和要求的变化。
10.4.3 主要措施
⑴ 提供疼痛控制与其他痛苦症状的临床医疗服务,使患者尽可能减轻痛苦。
⑵ 维护和尊重生命,把死亡看作一个正常的过程。不提倡放弃治疗和安乐死,也反对过度治疗。既不刻意加速死亡,也不刻意延缓死亡。
⑶ 整合患者的精神、心理和心灵为一体,进行姑息性照护。
⑷ 提供支持系统,帮助患者尽可能以积极的态度生活直到死亡。同时帮助患者家属正确对待患者的疾病过程和他们的居丧。运用团队工作满足患者及其家属的整体需求,包括居丧服务与咨询。
⑸ 同样适用于疾病过程的早中期,主要目的仍然是减轻患者身心痛苦,提高生活质量。
10.4.4 肿瘤相关症状的控制
10.4.4.1 疼痛
肿瘤晚期疼痛的处理应遵循三阶梯治疗原则。所谓癌痛三阶梯治疗,就是在对疼痛的性质和原因作出正确的评估后,根据患者的疼痛程度适当选择相应的镇痛药。即对于轻度疼痛的患者主要选用非阿片类镇痛药±辅助药物;对于中度疼痛的患者主要选用低剂量强阿片类药物±非阿片类镇痛药±辅助药物;对于重度疼痛的患者选用强阿片类药物±非阿片类镇痛药±辅助药物。
⑴ 按阶梯用药:按阶梯用药是指镇痛药物的选用应根据患者疼痛程度由轻到重,按顺序选择同强度的镇痛药物重度疼痛可以直接从强阿片类药物开始,以使疼痛快速减轻,缓解症状。另外,对一些患者有神经疼痛或精神心理症状的可以适当加辅助药物以提高疗效。
⑵ 按时用药:按时用药是指镇痛药有规律地按规定间隔时间给予,在稳态情况下大多使用控释剂型。每一种镇痛药必须先对患者疼痛的控制进行滴定剂量,由小到大调整至最佳剂量,这对于血药浓度的控制、药物剂量的计算和疼痛持续性缓解有益。如果患者在使用镇痛药同时有突发性剧痛,可以在原来的用药剂量基础上适当追加剂量,并在以后用药时重新滴定患者的总剂量。
⑶ 口服或无创用药:提倡无创用药,以口服给药为主。口服给药方法简便,且不易产生药物依赖性。在不能口服或口服反应过大的情况下也可选用另外的给药方法。
⑷ 个体化用药:药物的使用需因人而异,具体分析。
⑸ 注意具体细节:对用镇痛药的患者要注意监护,密切观察其疼痛的缓解程度和药物的不良反应,并及时采取必要的措施,目的是使患者获得最佳疗效而不良反应最小。并且随着疼痛控制及症状缓解,有的患者还可以逐步减少用药剂量而达到最优化治疗。
⑹ 癌痛管理应达到“4A”目标,即优化镇痛(optimize Analgesia)、优化日常生活(optimize Activities of daily living)、使药物不良反应最小化(minimize Adverse effects)和避免不恰当给药(avoid Aberrant drug taking)。
⑺ 为了达到4A目标,近年来的指南将小剂量三阶梯药物(如每日剂量≤30 mg的吗啡和每日剂量≤20 mg的羟考酮)划分到第二阶梯,临床上可用小剂量三阶梯药物处理中度癌痛。
麻醉性镇痛药的不良反应及处理包括:
⑴ 总体而言,阿片类药物用于癌性疼痛是安全有效的,但需要使用高剂量麻醉性镇痛药的患者或长期使用麻醉性镇痛药的患者,会出现一些症状如便秘、嗜睡和尿潴留等;其他症状包括有毒代谢产物蓄积而产生中毒现象,症状包括难治性恶心、嗜睡和瘙痒;神经性中毒症状包括幻觉、谵妄、肌颤和感觉异常;严重时可致呼吸抑制。
⑵ 治疗和预防这些不良反应的方式包括给予足够的水分及改变麻醉性镇痛药的种类,还要停止使用其他会增加不良反应的药物,事先对于预期会发生的不良反应进行预防性处理,对于已经出现的症状做相应的对症处理,并可使用解毒拮抗剂。
⑶ 谨慎对待脏器功能不全,尤其是肝肾功能不全的患者,麻醉性镇痛药的剂量要削减,避免可能发生的代谢产物蓄积造成对机体的伤害。
麻醉性镇痛药的耐药性和依赖性包括:
⑴ 麻醉性镇痛药的耐药性:一方面癌症患者因疾病进展导致疼痛的加重而必须增加麻醉性镇痛药的剂量,另一方面可能因患者产生耐药性而需要增加先前镇痛药的剂量才能达到相同的镇痛效果,其机理可能与麻醉性镇痛药受体水平的改变或代谢产物有关。
⑵ 生理上的依赖性:对于长期使用麻醉性镇痛药的患者,生理上的依赖是常见的反应。若突然中断麻醉性镇痛药或突然减低剂量,或应用麻醉性镇痛药的拮抗剂,患者可能会产生戒断症状及体征,如焦躁不安、颤抖、发热、出汗、瞳孔放大、心跳加快、肌肉和腹部痉挛。此时需要减量或停用麻醉性镇痛药,必须以每天10%~20%的速度缓慢递减。
⑶ 心理上的依赖性(成瘾性):这是一种用某种物质后产生的心理变态强迫症,结果造成使用者生理、心理和社会学方面的伤害,而且即使发生伤害,使用者仍会强迫性地持续使用药物。实际上,无酒精或药物依赖病史的癌症患者若合理地使用适当的麻醉性镇痛药很少出现心理上的成瘾性。
10.4.4.2 厌食和恶病质
终末期癌症患者常发生厌食和营养不良,又称为厌食-恶病质综合征,主要是肿瘤导致的机体代谢功能紊乱,包括细胞因子分泌异常,胰岛素、肾上腺皮质激素代谢紊乱,免疫功能抑制,脂肪和蛋白质分解增加等,也可能归因于肿瘤治疗的影响或心理因素。
临床表现包括体重明显减轻、肌肉萎缩、厌食、乏力、味觉异常、贫血、低蛋白血症、水肿、褥疮及精神萎靡等。
治疗原则主要考虑纠正代谢的异常,适当营养支持,加强心理支持和护理。在具体临床实践中要注意既不能给予过少的营养成分和能量而达不到营养支持的目的,也不能给予太多的支持,特别是对于老年和脏器功能障碍的患者。
根据实验室检查指标和出入量给予一定的营养物质和能量,建议以肠内营养为主,为纠正水电解质异常或肠内营养不足可适当进行静脉营养,此外固醇类皮质激素、孕激素(甲地孕酮、甲羟孕酮)及胃动力药物等可适当作为辅助治疗。
10.4.4.3 恶心和呕吐
⑴ 明确呕吐原因,如治疗相关性呕吐(如化疗、放疗等)、疾病相关性呕吐(如脑转移、胃肠道梗阻等)。
⑵ 针对原因进行治疗,如放疗和化疗前预防性给予止吐药物、脑转移者给予脱水、胃肠道梗阻者给予胃肠减压等处理。
⑶ 非特异性的恶心呕吐给予多巴胺受体拮抗剂或苯二氮卓类药物,尤其适用于焦虑所致的恶心和呕吐。
⑷ 顽固性恶心和呕吐可持续静脉给药或皮下给药,如可进行多巴胺受体拮抗剂的剂量滴定至最大获益和耐受水平。若恶心仍持续存在,可考虑加用5-羟色胺受体拮抗剂、抗胆碱能药物和(或)抗组胺药物、糖皮质激素、安定类药物甚至大麻类药物。针灸和镇静剂也可以考虑。
⑸ 注意剧烈呕吐有可能引起上消化道出血,另需注意电解质平衡。
10.4.4.4 疲乏
疲乏是肿瘤晚期一种很常见的严重症状,几乎所有的晚期患者都有疲乏现象,特别是病情进展至终末期。它能使患者心理和生理承受能力降低,失去正常的生活能力。患者可能在病程的早期就有疲乏现象,也可能因肿瘤相关治疗而加重疲乏症状。
临床表现为体力不足、倦怠不适、嗜睡及智能减退,这些严重影响患者的生活质量。疲乏也可能使患者的其他症状如疼痛、抑郁及睡眠障碍等更加严重。
疲乏多数由营养不良、恶病质、药物和放疗、疼痛、情绪和睡眠障碍、水电解质紊乱(如低血钾、低血钠及脱水等)、缺氧、代谢障碍(如肿瘤消耗、血糖变化及酸中毒)、血象过低(如贫血)、心肝肾功能衰竭、内分泌紊乱或感染等引起。
治疗一般先针对病因(如镇痛、抗感染及保护心肝肾功能),纠正不足(如水电解质、血糖、红细胞、白细胞、血小板及血氧),支持治疗中可考虑加用一些肾上腺皮质激素如地塞米松或孕激素如甲地孕酮、甲羟孕酮,也可佐以精神兴奋剂如哌甲酯。
10.4.4.5 昏迷
昏迷是脑功能严重障碍的一种临床表现,其生命体征尚存而持续性意识丧失,终末期患者尤其是生命时间无多的患者多见。根据对疼痛有无退缩反应、瞳孔反射与角膜反射是否存在等可将昏迷程度分成浅昏迷和深昏迷。
临床表现:①浅昏迷时,患者意识大部分丧失,无自主活动,受强刺激时,可出现痛苦表情和肢体退缩反应,受到疼痛刺激时可出现防御反射,角膜反射、眼球运动和吞咽反射尚存在,常有病理性反射,可发生尿失禁或尿潴留。②深昏迷时,患者意识完全消失,所有深浅反射均消失,四肢松弛性瘫痪,仅维持呼吸、循环功能。
肿瘤患者出现昏迷的常见原因为颅脑占位性病变、恶性肿瘤中枢神经系统受侵犯、高热、感染、代谢障碍、电解质紊乱及脑出血等。
癌症患者出现昏迷多数预示病情已晚,预后极差,治疗宜适度。①病因治疗:对颅脑占位性病变,恶性肿瘤中枢神经系统受侵犯行脱水、激素等治疗,高热、感染、代谢障碍、电解质紊乱及脑出血等应针对病因支持治疗,浅昏迷可用局部姑息性放疗。②支持治疗:保证糖分和营养适度,维持静脉通路,纠正酸碱失衡,保持水和电解质的平衡。③加强护理:尽量使患者头部偏向一侧,注意保暖,留置导尿管,保持皮肤干燥清洁,注意防治褥疮。另外,保持呼吸道通畅,缺氧或呼吸困难可给予氧气,有感染时合理选用抗生素,必要时可酌情使用醒脑静等药物。但深昏迷时,患者已无多大痛苦,若家属同意或有要求,可不进再一步处理。
11
乳腺癌患者随访与康复共识
乳腺癌患者随访的目的在于了解患者的生存状况,评估疾病是否复发转移,以及患者对辅助治疗的依从性和不良反应等,以采取相应的临床和干预措施,更好地康复并改善预后。
乳腺癌患者的康复包括生理功能的康复、心理状态的调整及社会活动能力的恢复。乳腺癌的康复治疗就是在乳腺癌正规治疗的同时或结束后,帮助患者恢复机体生理功能、调整心理状态,并且能够回归社会,重建被疾病破坏了的生活。
11.1 随访和评估
11.1.1 随访频率
乳腺癌患者的随访需要根据复发的风险来决定随访的频率,参照建议如下:
⑴ 术后2年内,一般每3个月随访1次。
⑵ 术后3~5年,每6个月随访1次。
⑶ 术后5年以上,每年随访1次,直至终身。如有异常情况,应当及时就诊而不拘泥于固定时间。
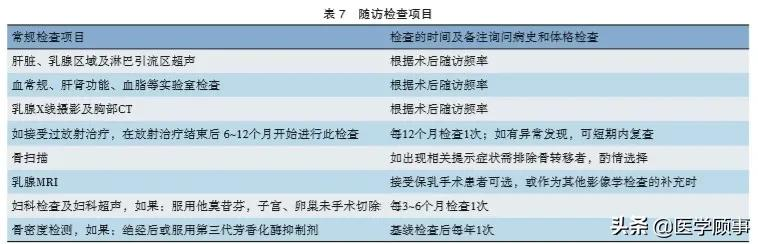
11.1.2 随访检查项目
随访检查项目的具体内容见表7。
11.1.3 随访评估项目
11.1.3.1 上肢功能评估
⑴ 上肢活动范围:应当在乳腺癌术后1~2个月内恢复正常水平。如运动受限,则需要强化功能锻炼或进一步就诊治疗。
⑵ 患肢淋巴水肿:接受腋窝手术的乳腺癌患者需要在术后随访期间评估上肢淋巴水肿的情况。淋巴水肿评估方法较多,临床主要通过询问患者主观感受或体检并进行多节段臂围测量判断。一般认定患侧上肢周径比对侧上肢周径长<3 cm为轻度水肿,3~5 cm为中度水肿,>5 cm为重度水肿。
11.1.3.2 并发疾病风险评估
⑴ 心脑血管事件风险评估:
①心脏毒性:接受过含蒽环类药物(尤其含多柔比星)方案化疗或曲妥珠单抗、帕妥珠单抗等抗HER2靶向药物治疗的患者需定期进行心电图及心脏超声(左心室射血分数)检查,蒽环类药物使用后还需考虑心肌酶谱检查,及时发现用药可能带来的心脏毒性及心脏事件风险。
② 血脂异常:接受内分泌治疗(如他莫昔芬或第三代芳香化酶抑制剂等)的患者,应当评估血脂(胆固醇、甘油三酯、低密度脂蛋白等)情况以判断是否存在血脂异常。
⑵ 骨折事件风险评估:服用第三代芳香化酶抑制剂或卵巢去势的患者需在药物使用前及每年随访时进行骨密度检测及骨折风险评估,以判定骨折风险属低危、中危或高危。
11.1.3.3 生活方式评估
⑴ 体重评估
第一次随访时,测量患者的身高和体重。以后每次随访都测量体重。每次测量后计算患者的体重指数(body mass index,BMI),按照《中国成人超重和肥胖症预防控制指南》评价患者的BMI是否过低、正常、超重或肥胖。
⑵ 营养与运动
询问患者每日食物摄入情况。推荐使用24 h回顾法,连续记录3 d饮食量。评价患者的食物摄入量、主要营养素是否符合推荐、膳食结构合理程度。如果患者没有特殊情况,按《中国居民膳食指南》推荐的摄入量进行评估。
询问患者每天的体力活动情况,是否有规律地进行快走、慢跑、跳舞、游泳等体育锻炼,如有,每天或每周一共进行多长时间。
⑶ 其他
询问患者是否吸烟,是否被动吸烟,是否饮酒,如有,询问频率和数量。询问患者是否使用保健品或膳食补充剂,如有,具体什么产品及使用频率。
11.1.3.4 心理和社会支持评估
乳腺癌患者的不良情绪主要集中在自尊、身体影响、焦虑和抑郁。随访时应当通过问诊或量表等形式对患者的心理状态及社会支持状态进行评估。
11.1.3.5 性生活和生育评估
乳腺癌治疗和由治疗而引发的不良反应,如乳房切除使自身形象改变、更年期症状提前出现等会在一定程度上影响性生活,而治疗的持续或不良反应也会影响育龄期乳腺癌患者生育功能的康复。因此,需要以问诊、量表等形式评估并随访其性生活及生育需求。
11.2 不同瘤种临床试验中的有效性结果
11.2.1 患侧肢体功能的康复
11.2.1.1 循序渐进的患侧上肢功能锻炼
功能锻炼对于恢复患者肩关节功能和预防及减轻水肿至关重要,但必须严格遵守循序渐进的顺序,不可随意提前,以免影响伤口的愈合。
循序渐进方法:①术后1~2 d,练习握拳、伸指、屈腕;②术后3~4 d,前臂伸屈运动;③术后5~7 d,患侧的手摸对侧肩、同侧耳(可用健肢托患肢);④术后8~10 d,练习肩关节抬高、伸直、屈曲至90°;⑤术后10 d后,肩关节进行爬墙及器械锻炼,一般应在1~2个月内使患侧肩关节功能达到术前或对侧同样的状态。
功能锻炼的达标要求:2周内患侧上臂能伸直、抬高绕过头顶摸到对侧耳朵。达标后仍需继续进行功能锻炼。
值得注意的是,术后7 d内(尤其腋下引流管拔除前)限制肩关节外展。严重皮瓣坏死者,术后2周内避免大幅度运动。皮下积液或术后1周引流液超过50 mL时应减少练习次数及肩关节活动幅度(限制外展)。植皮及行背阔肌皮瓣乳房重建术后要推迟肩关节运动,避免在术后早期进行过度锻炼。
11.2.1.2 上肢淋巴水肿的预防
⑴ 预防感染:保持患侧皮肤清洁;不宜在患侧手臂进行有创性的操作,如抽血、输液等;洗涤时戴宽松手套,避免长时间接触有刺激性的洗涤液;避免蚊虫叮咬;衣着、佩戴首饰或手表时一定要宽松。
⑵ 避免高温环境:避免烫伤;患侧手臂不要热敷,沐浴时水温不要过高,避免长时间热浴或桑拿;避免强光照射等高温环境。
⑶ 避免负重:术后2~4周内避免上肢负重,一般不超过500 g。4周后,需缓慢、逐渐增加肌肉及肌耐力的活动,尤其是抗阻力训练。但仍需避免提、拉、推过重的物品;避免从事重体力劳动或进行较剧烈的体育活动。
⑷ 避免上肢近端受压:避免紧身衣、测量血压、患侧卧位。
⑸ 注意睡姿,保证睡眠质量:平卧位患侧肢体垫高,手臂呈一直线,手掌高度要超过心脏平面;健侧卧位,患肢放于体侧或枕头垫高超过心脏水平。良好的睡眠能够帮助患者放松心情,兴奋迷走神经,激活淋巴系统,预防并改善淋巴水肿。
⑹ 其他:建议进行患者教育以帮助患者早期识别水肿及水肿风险,根据手术类型、是否放疗、生活方式等进行风险评定,不要忽视轻微的手指、手背、上肢的肿胀,对于高危患者进行早期干预。建议鼓励患者尽快恢复手臂功能;乘坐飞机、长途旅行或是处于高海拔地区时穿戴预防性弹力袖套;在医师指导下进行适当的体育锻炼,避免过度疲劳。
11.2.1.3 上肢淋巴水肿的治疗
包括保守治疗和手术治疗。保守治疗指综合消肿疗法,包括人工淋巴引流、压力绷带治疗、皮肤护理、功能锻炼等,需要多学科共同参与。手术治疗包括淋巴结移植、淋巴管吻合等,疗效尚有待大规模研究证实。如患侧手臂出现红肿热痛等症状,亦或水肿突然加重等应考虑淋巴管炎可能,应及时检查血常规并予以抗炎处理。
11.2.2 并发疾病
11.2.2.1 心脑血管事件风险管理
⑴ 心脏毒性管理
应当充分评估心脏基础疾病,避免心脏毒性药物在此类人群中的使用。可考虑在蒽环类药物治疗同时给予右雷佐生;若疑似存在心功能异常,则可使用血管紧张素转换酶抑制剂、血管紧张素受体阻断剂以及特定β受体阻断剂,有助于防止蒽环类药物诱导的心肌病发生。
治疗期间及治疗后随访期间如发现心脏症状体征、心肌酶谱异常或心脏超声异常,应当及时停药并复查,如持续存在异常则需即刻停止使用导致心脏损害的药物并及时给予治疗,并需要多学科专家共同参与诊疗。
⑵ 血脂管理
生活方式干预有助于预防血脂异常的发生;同时注意定期对血脂进行检测。结合临床病史和(或)危险因素决定是否开始调脂药物治疗。他汀类药物是临床上最常用于调脂的药物,且他汀类药物与内分泌治疗药物间无相互作用。有研究证实,同时使用第三代芳香化酶抑制剂与他汀类药物不仅可降低血脂,还能延长乳腺癌患者的无病生存期(disease-free survival,DFS)。
11.2.2.2 骨折风险管理
应当对所有绝经后及使用第三代芳香化酶抑制剂的患者宣教骨折事件的预防方法,并进行生活方式干预。骨折风险评估为中高危的患者,除需改善生活方式外,还应及时给予适当的药物(补充钙剂、维生素D及使用双膦酸盐制剂或地舒单抗等),并密切监测骨密度。
11.2.3 生活方式管理
越来越多的循证医学证据表明,乳腺癌患者的生活方式影响预后。乳腺癌患者诊断以后的膳食营养状况、BMI变化、体力活动状况及吸烟饮酒等个人生活方式相关因素与乳腺癌患者的转移复发、无病生存和死亡率相关。乳腺癌患者长期生存,不仅需要长期的医疗和康复服务,而且需要对其日常生活进行指导,帮助乳腺癌患者形成并坚持健康的生活方式,从而提高治疗效果,改善预后,提高生活质量和生存率。
11.2.3.1 BMI管理
乳腺癌患者在治疗结束后,应尽量使BMI恢复到正常范围,即BMI在18.5~23.9 kg/m2的范围内,或按照《中国成人超重和肥胖症预防控制指南》达到体重正常标准。
对于已经超重或肥胖的乳腺癌患者而言,推荐降低膳食的能量摄入和接受个体化的运动减肥指导。
对于积极抗癌治疗之后处于营养不良或体重过轻状态的患者,必须由专科医师和营养师进行评估,制订和实施营养改善计划;也推荐这些患者进行一定的体力活动,帮助改善身体机能和增加体重,但应避免剧烈运动。
11.2.3.2 营养与运动
按照“中国居民平衡膳食宝塔”选择食物,安排一日三餐的食物量。推荐富含水果、蔬菜、全谷类食物、禽肉和鱼的膳食结构,减少精制谷物、红肉和加工肉、甜点、高脂奶类制品和油炸薯类食物的摄入。
建议乳腺癌患者在诊断后应避免静坐生活方式,尽快恢复诊断以前的日常体力活动;18~64岁的成年人,每周坚持至少150 min的中等强度运动(大致是每周5次,每次30 min),或者75 min的高强度的有氧运动;力量性的训练(大肌群抗阻运动)每周至少2次。建议每次锻炼以10 min为一个间隔,最好每天都锻炼。超过65周岁的老年人应尽量按照以上指南进行锻炼,如果患有使行动受限的慢性疾病,则根据医师指导适当调整运动时间与运动强度,但应避免长时间处于不运动状态。
11.2.3.3 吸烟饮酒、保健食品和膳食补充剂
建议乳腺癌患者不吸烟,避免被动吸烟,不饮酒,避免含有酒精的饮料。对于保健食品和膳食补充剂,建议如下:
⑴ 应尽量从饮食中获取必需的营养素。
⑵ 在临床(血浆维生素D浓度低、维生素B12缺乏)或生化指标(骨密度低)提示营养素缺乏时,才需要考虑在营养师的指导下服用相应的营养素补充剂。
⑶ 经营养师评估,当患者无法从食物中摄取足够的营养素,摄入持续下降到只有推荐量的2/3时,可以考虑服用营养素补充剂。
11.2.4 心理和社会支持
11.2.4.1 心理支持
医护人员需要了解患者的心理变化特点及心理状态调整的过程,以提供必要的心理干预。
医护人员可以在认知、决策、应对技能等方面提升患者的自我控制能力,指导患者合理地运用暗示、宣泄等应对技巧,以增加对于困境的忍耐力。避免给予患者过多的同情与怜悯,向患者强调保持常态的重要性,帮助患者尽快摆脱患者角色,积极面对生活。
⑴ 提供充分信息,帮助患者理性接受患病事实。医护人员可参与患者的认知矫正,帮助患者进行适当的反思,摒弃错误的想法,减轻患者的恐惧。
⑵ 帮助患者寻找积极的生存目的,重建生活的信心。医护人员必须及时且正确地评估患者当前的期望,包括患者与其家属之间的依赖关系。帮助患者意识到自身的价值,对家庭其他成员的重要性,以增加其与疾病抗争的信心。鼓励患者参加社会活动,提供社会角色恢复的机会。
⑶ 激发患者的承担意识,协助其有效地控制自我。实施以患者为中心的医疗护理模式,帮助患者充分发挥她们的决策权,激发她们的自我承担意识。
评估中如发现中重度心理异常患者,需要包括药物治疗在内的跨学科综合治疗手段介入并密切随访。
11.2.4.2 社会支持
医护人员可以根据患者的需要,积极调动社会资源,给患者提供帮助、鼓励和支持,最大限度地恢复患者的社会功能。建议所有的女性都应该得到治疗小组的情感支持和社会支持,也应该得到同辈支持小组的信息和支持。乳腺癌患者的社会支持网络应涵盖专业支持、家庭支持和同辈支持。
⑴ 专业支持:以提供医学信息和心理支持为主,可以开设康复课程、专业讲座,设立康复热线、康复值班室、康复网站,出版康复相关的书籍等,同时利用各种新媒体平台、手机应用程序等。
⑵ 家庭支持:以鼓励家属参与患者的诊治和康复过程为主,可以开设家属信息咨询窗口,为家属提供交流平台等。
⑶ 同辈支持:以康复病友志愿者的参与为主,可以采用病房探视或新病友座谈会的形式,建议在医护人员的专业指导和监督下进行。
11.2.5 性生活和生育
11.2.5.1 性生活
乳腺癌患者健康及适度的性生活有利于身心康复。唯一需要提醒的是严格进行避孕,而避孕方法推荐物理屏障避孕法,避免使用激素类药物避孕法。
⑴ 要让患者认识到,无论将采用何种治疗手段,经爱抚获得愉悦的能力不会改变。
⑵ 提醒患者,可试着享受其他感觉性愉悦的方式,伴侣间应该互相帮助,通过触摸和爱抚来达到性高潮。
⑶ 与伴侣进行关于性问题的交流,或向专业人员咨询。
11.2.5.2 生育及生育功能保留
虽然目前没有证据显示生育会影响乳腺癌患者的预后,但在选择是否生育,以及何时生育时必须充分考虑患者疾病复发的风险和治疗对后代的影响,与患者也要有充分的沟通。以下情况可考虑生育:
⑴ 乳腺原位癌患者手术和放疗结束后。
⑵ 淋巴结阴性的乳腺浸润性癌患者手术后2年。
⑶ 淋巴结阳性的乳腺浸润性癌患者手术后5年。
⑷ 需要辅助内分泌治疗的患者,在受孕前3个月停止内分泌治疗(如戈舍瑞林、亮丙瑞林、他莫昔芬等),直至生育后哺乳结束,再继续内分泌治疗。
在全身治疗前应当考虑生育功能保留的手段实施,目前较为广泛使用的手段包括:胚胎冻存、冻卵、低温保存卵巢组织。使用促性腺激素释放激素类似物用于化疗期间卵巢功能保护的疗效尚待大规模临床研究证实。