本篇目录:
1、镓的简化电子排布式是什么?2、Ar的熔沸点3、化学高考请进:为什么Ar的熔沸点比Ne的高4、已知稀有气体He,Ne,Ar,Kr,Xe的沸点从左至右依次升高,解释为什么。_百度...5、...A.H2OH2TeH2SeH2SB.HeNeArKrC.I2Br2Cl2F镓的简化电子排布式是什么?
1、元素的简化电子排布式是一种表示元素电子结构的方法,它用来表示元素原子中电子的分布和排布方式。
2、最后,按照人们的习惯“每一个电子层不分隔开来”,改写... 问题二:电子的排布式,电子排布图,电子轨道表达式,表示式的区别。
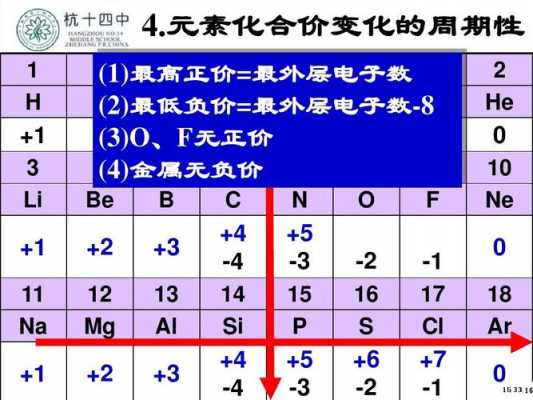
3、电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1 。
4、镓属于第四周期ⅢA族元素,所以第三电子层已经排满,电子排布式是[Ar]4s2 4p1,也就是1s1 2s2 2p6 3s2 3p6 3d10 4s2 4p1。
Ar的熔沸点
氩气是一种稀有气体,化学式为Ar,相对分子量为395,熔点为-182℃,沸点为-187℃,微溶于水,性质稳定。氩气在普通大气压下无毒。
ar是氩气。氩气是单原子分子,单质为无色、无臭和无味的气体。是稀有气体中在空气中含量最多的一个,100升空气中约含有934毫升。密度784克/升。熔点-182℃。沸点-187度。电离能为1759电子伏特。

这是由于它的物理性质决定的 熔点是-182℃即895K,低于84K为固态,沸点为-187℃,所以室温下为气态。
化学高考请进:为什么Ar的熔沸点比Ne的高
【答案】:因为从He到Xe相对分子质量依次增大,而分子的色散力是随相对分子质量依次增大而增大,色散力又是分子间力中主要的一种,分子间作用力大,沸点就高,所以稀有气体的沸点,从He到Xe的次序升高。
Ar的熔沸点-182°C。氩,元素符号:Ar是一种稀有气体。氩在通常条件下位无色、无味气体;熔点-182°C,气体密度784克/升。水中溶解度36厘米3/千克水。
(2)稀有气体He,Ne,Ar,Kr,Xe单质的沸点随着原子量的增加而升高。相对分子质量越大,分子间作用力越大,熔沸点越高。(3)HCl,HBr,HI的熔点沸点随摩尔质量增大而增大。
例如:MgOCaO,NaFNaClNaBrNaI。⒊分子晶体:熔、沸点的高低,取决于分子间作用力的大小。一般来说,组成和结构相似的物质,其分子量越大,分子间作用力越强,熔沸点就越高。例如:F2Cl2Br2;CCl4CBr4CI4。
已知稀有气体He,Ne,Ar,Kr,Xe的沸点从左至右依次升高,解释为什么。_百度...
原子晶体的熔、沸点高于离子晶体,又高于分子晶体。金属单质和合金属于金属晶体,其中熔、沸点高的比例数很大(但也有低的)。在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
稀有气体或惰性气体是指元素周期表上的18族元素(IUPAC新规定,即原来的0族)。在常温 常压下,它们都是无色无味的单原子气体,很难进行化学反应。
稀有气体化学式有He、Ne、Ar、Kr、Xe、Rn、Og。稀有气体 稀有气体是指元素周期表上所有0族元素对应的气体单质,也称为惰性气体。在常温常压下,它们都是无色无味的单原子气体,很难进行化学反应。
(3)稀有气体(He、Ne、Ar、Kr、Xe等的总称):保护气、电光源(通电发不同颜色的光)、激光技术。化合价,a.写法及意义:MgCl2:氯化镁中镁元素化合价为+2价。b.几种数字的含义Fe2+每个亚铁离子带两个单位正电荷。
相对分子质量401 熔点 -56 沸点 -748(升华)备注:沸点比熔点低所以液态二氧化碳少见。无色,无味气体。 易溶于水(体积比1:1),部分生成碳酸。
...A.H2OH2TeH2SeH2SB.HeNeArKrC.I2Br2Cl2F
分子间作用力越大。另外,当氢键存在时,有氢键物质的熔沸点高。
而根据热力学,能量越低越稳定。知道a、b、c、d依次为H2Te、H2Se、H2S、H2O。(3)硒化氢在热力学标准态下,发生分解反应的热化学反应方程式为:H2Se(g) = H2(g) + Se(s),△H = -81kJ/mol。
食盐NaCl,是离子化合物。溶解后形成钠离子和氯离子,所以克服的并不是分子间的作用力。干冰是分子化合物,升华是由固态的二氧化碳变成所态的二氧化碳,所以克服的是分子间作用力。
金属晶体 分子晶体 因为对于原子晶体 金属晶体 离子晶体,其熔沸点是由其成键 形式 决定的。
例如,I2Br2Cl2,CI4CBr4CCl4CF4。⑵但如果分子之间存在氢键时,其对分子晶体的熔点和沸点的影响更大,例如,HFHIHBrHCl,H2OH2TeH2SeH2S,NH3AsH3PH3。
到此,以上就是小编对于acn沸点的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。